ESTUDIO COMPARATIVO DE DOS PROCESOS DE ESCALDADO UTILIZANDO CALOR HUMEDO Y MICROONDAS .
Juan l. Corujo, Julio Cosbert, Katya Kapellmann, Adriana Regalade,Cristina Silva y Pablo Robles-Arenas.
Centro de Investigación, Universidad La Salle
RESUMEN.
Las diferencias entre dos procesos de escaldado, utilizando calor húmedo y microondas, fueron analizadas en muestras de mango (manila), plátano
(tabasco), guanábana, pera y manzana. Los rangos de temperatura variaron de 75 a 90° C para
calor húmedo, y de 30 a 50° e para microondas. El escaldado por microondas requiere
de menor tiempo y presenta un mayor porcentaje de inactivación enzimática que el
calor húmedo. pero para fines industriales. el escaldado por microondas representaría una mayor inversión económica.
INTRODUCCIÓN.
Cuando en los procesos de conservación o transformación de vegetales intervienen operaciones de corte o destrucción de material celular. se liberan
enzimas de actividad muy variables, que pueden generar reacciones indeseables en los vegetales.
El esca ldado es un proceso térmico previo a las operaciones de envasado, deshidratación o congelación de alimentos de orígen vegetal por espacio de
algunos minutos o incluso segundos , utilizando agua caliente o vapor. o la mezcla de ambos.Se efectúa para inactivar enzimas, eliminar aire atrapado
en los tejidos. fijar el color verde y reducir el número de microorganismos o acomodar los productos foliáceos en envases. Para medir la efectividad
del escaldado se realizan las pruebas de la catatasa y peroxidasa (1).
Las condiciones de tiempo y temperatura son muy importantes durante el proceso. ya que a temperaturas superiores a las necesarias se pueden producir
daños a los productos. tales como: pérdida de nutrientes por lixiviación , volatilización de aromas. hidrólisis y oxidacion es, entre otras (2).
Las microondas son ondas electromagnéticas de energía radiante con una longitud de onda entre 2.5 y 75 cm aproximadamente, que corresponden a una
frecuencia de unos 20.000 a 400 rnegaciclos por segundo (3).
Una aplicación del microondas con los alimentos. es la de inactivación de enzimas. El calor producido por las microondas puede producir un
calentamiento uniforme y rápido hasta alcanzar temperaturas de inactivación, controlando y poniendo fin a las reacciones enzimáticas. Las microondas no
calientan excesivamente el exterior de los productos antes de lograr la inactivación de las enzimas del núcleo central (3)
Algunos cambios en los nutrientes al usar microondas pueden ocurrir en proteínas de orígen no animal, reduciendo el contenido de nitrógeno no protéico,
nitrógeno de la proteína y aminoácidos libres y totales. En el caso de vegetales como los chícharos, provocan una retención menor de varios aminoácidos
como la histidina. glicina, cisteína y metionina (4).
El tratamiento térmico con microondas no presenta reacciones de Ma!llard en alimentos. por lo tanto el valor nutrícional de estos es muy alto.


MATER!AL Y METODOS.
Determinación cualitativa de 1nactivacíón enzimática
Se preparan 80 mide una mezcla 1:1 de guayaco! (1% en Etanol-Agua , 1:1) y peróxido de hidrógeno (solución acuosa al 0.1%) , donde se sumergieron tiras
de papel filtro (Whatman No. 2} de 1 por 5 cm y se eliminó el exceso de la solución.
Para este estudio, se utilizaron cinco muestras de fruta : mango (manila). plátano (Tabasco), guanábana. pera (Max Red Bartlett) y manzana (Starking).
Se cortaron las muestras en pequeños cubos (3*3 cm) y se escaldaron mediante calor húmedo utilizando temperaturas de 75, 80 y 90º C. Posteriormente,
otras muestras se escaldaron utilizando un horno de microondas (Panasonic NN-6368). a temperaturas de 30, 40 y 50° C.
Las muestras se presionan fuertemente sobre el papel filtro humedecido con la mezcla de guayaco! y peróxido de hidrógeno (1:1), y en menos de 30
segundos apareció una coloración salmón, indicativo de que la prueba fue positiva. Se determinó el tiempo exacto en que cada muestra escaldada a
diferentes temperaturas coloreó de salmón el papel filtro. Posteriormente, se realizaron curvas de tiempo temperatura.
Determ111ación
c
uantitativa
d
e
inactivac16n enzimática
Se molieron en un mortero alrededor de 20 g de muestra (fresca, escaldada y cocida). mezclándola con el agua necesaria para obtener un suero. Se
centrifugó (550 rpm) un volumen aproximado de 20 mi en una centrifuga Sol-Bat durante 15 minutos y se distribuyó el suero en diferentes tubos de ensayo
como se indica en la Tabla 1.
TABLA
1
Distribución de Suero para la Determinación Cuantitativa del Porcentaje de lnactivación Enzimática.
|
Reactivo
|
Blanco
|
1
|
11
|
111 (mi}
|
|
Suero veg. fresco
|
|
2
|
|
|
|
Suero veg. escaldado
|
|
|
2
|
|
|
Suero fruto cocido Agua
|
|
2
|
|
2
|
|
Guayacol
|
1
|
1
|
|
|
|
Peróxido de hidrógeno
|
1
|
1
|
|
|
Se añaden los reactivos necesarios (agua, guayacol y peróxido de hidrógeno) como se indica en la Tabla 1. Cada tubo se agitó vigorosamente y
se realizó la lectura en un espectrofotómetro Spectronic-20 (Bush and Lomb, USA) a 420 nm, calculando el porciento de inactivación como se indica a
continuación:
(Abs. veg. fresco - Abs. veg. escaldado)
% Inactivación= -------------- -- ----- -- ---- --- ------·-------- x 100
{Abs. veg. fresco - Abs. veg. cocido)
DISCUSIÓN DE RESULTADOS
Determinación cualitativa de mactividad enzimática
Los resultados del esca ldado obtenidos con las muestras de mango, plátano, guanábana. manzana y pera utilizando calor húmedo se muestran en la Figura
1.
Por medio del calor húmedo se utilizó un mayor rango de temperatura (75 a 90º C). en
temperatura óptima 80º c. Para manejos prácticos esta temperatura es favorable, debido a un mejor control de tales condiciones, ya que
control es más difícil y a tiempos mayores, se gasta mayor energía.
 Figura No 1 Determinación Cualitativa mediante
Figura No 1 Determinación Cualitativa mediante

uo ·--1)
llO
100
y la manzana, se podría manejar a
75° C, ya que habría mayor tiempo para controlar el proceso, sin un aumento considerable en el gasto
60
'º
zo --,-.....,
__ _
energético .
La velocidad de inactivación en pera y manzana es similar, siendo ésta un valor alto debido al bajo contenido de enzimas fenol oxidasas. El plátano y
la guanábana tienen también valores muy similares. presentando velocidades de inactivación bajas.
o --------------.. ...
1 --------):- --._ -
- ---------·--·
|
|
15
80
90
Grados C
Maaao B&llllllA _._ · Gu. 1a.,bana
-W- Maauaa
 como resultado a una mayor concentración de estas enzimas.
como resultado a una mayor concentración de estas enzimas.
El mango presenta un valor intennedio entre ambos pares de muestras. A pesar de no contener una concentración alta de enzimas, la velocidad de
inactivación se ve afectada por su alta cantidad de vitamina C.
Según el Instituto Nacional de Nutrición (INA1987), el mango (manila) contiene en promedio unos 76 mg de ácido ascórbico (Vit. C). Esta substancia
retarda el pardeamíento enzimático en virtud de su poder reductor. Reduce las o-quinonas nuevamente a sus o-difenoles originales (2).
Los resultados obtenidos del escaldado mediante el uso de microondas se muestran en la Figura 2

 Figura No.2 Determinación Cualitativa mediante
Figura No.2 Determinación Cualitativa mediante
Microondas
Tiempo (sg)
70
60
50
., ,
40
30
20 -·------·-------·---------
La temperatura óptima de inactivación registrada fue 40° C, ya que proporciona tiempos cortos y accesibles para manejos industriales. Nuevamente, los



 tiempos de inactivación para todas las muestras mostraron un patrón muy similar.
tiempos de inactivación para todas las muestras mostraron un patrón muy similar.

 Nota el método de guayaco! y peróxido mide la cantidad de peroxidasa activada indirectamente. mediante la formación de o quinonas. mismas que colorean
de color salmón el pael filtro con la solución guayaco! y pernxidasa. Sí esta se inhibe. ninguna otra enzima
Nota el método de guayaco! y peróxido mide la cantidad de peroxidasa activada indirectamente. mediante la formación de o quinonas. mismas que colorean
de color salmón el pael filtro con la solución guayaco! y pernxidasa. Sí esta se inhibe. ninguna otra enzima
10
o--
----------·-·--
que cause obscurecimiento puede seguir activada.
30 40 so
Grados e
Determinación cuantativa de
inactivacíón enzimática
L__
Mango
Manzaia.a
,
Ptra
Gvaa4baaa
Los resultados que se obtuvieron en el porc1ento de inactivac1ón se muestran en la Tabla 2.
TABLA 2
Determinación Cuantitativa de lnactivación Enzimatica

Muestra o/o enzima inactivada
 (calor húmedo)
(calor húmedo)
% enzima inactivada
(microondas)
Mango 90
Plátano 78
Guanábana 83
Pera 86
Manzana 80
100
92
96
95
93
El escaldado mediante microondas mostró inactivación enzimática en tiempos más cortos y con un mayor porcentaje de inactivación. Esto se debe a que la
longitud de onda del microondas provoca una vibración en las moléculas de agua. proporcionando así un calentamiento más uniforme a nivel celular. Esto
pcovoca un rompimiento de los enlaces moleculares de las enzimas. y se bproduce la desnaturalización de éstas. La única desventaja de este proceso, es
que debido al tamaño requerido de un horno microondas para satisfacer las demandas de una línea de prnceso, la inversión económica y el gasto de
energía serían muy altas.
Hasta hace muy poco. los generadores de microondas estaban limitados a cerca de 30 k.W. incorporando al microondas un precalentamiento al vapor y un
control de humedad para obtener una mayor eficiencia. Sin embargo, con el desarrollo reciente de generadores de 60 kW, que a la vez permiten un
calentamiento más uniforme. la factibilidad económica de usar microondas en la industria debe ser revisada (5).
El calor húmedo utiliza más tiempo para calentar uniformemente al producto. Sin embargo. la factibilidad de utilizar calor húmedo en la industria es
mucho mayor en cuanto a costos de inversión. Inclusive, es factible reutilizar el vapor saturado indefinidamente.
La inactivación cuantificada en el mango puede ser nuevamente el resultado de un efecto combinado de ondas cortas y la acción de vitamina C.
CONCLUSIONES.
El escaldado por microondas requiere de menor tiempo y presenta un mayor porcentaje de inactivación que el calor húmedo. pero para fines comerciales (y
a la espera del desarrollo de nueva tecnología) el escaldado por microondas puede provocar un mayor grado de inversión económica.
La vitamina e tiene un efecto importante en la inhibición de la acción enzimática que produce el obscurecimiento de frutas, mismo que se puede aumentar
gracias a la acción de las ondas cortas del microondas.
AGRADECI MIENTOS.
Agradecemos el apoyo de la Escuela de Ciencias Químicas de la Universidad La Salle en el préstamo de laboratorios y reactivos para la realización de
este trabajo de investigación. y al Químico en Alimentos Enrique Rudiño Piñera por la asesoría prestada.
REFERENCIAS .
1. BAOUI, S. Diccionario de Tecnología de Alimentos Ed. Alhambra Universidad; México D.F. pp. 53. 1988.
2. BRAVERMAN, México D.F. 1976.
HAFEZ. Y.S.
Protein. J. Food Sci.
J.B . Introducción a la Bioquímica de los Alimentos. Ed. Manual Moderno,
Effects of Microwave Heating on Solubility Oigestibility and Metabolism of Soy 50(2) : 415-417, 423. 1985.
3. POTTER. N. N. La Ciencia de los Alimentos. Ed. Edutex. México D.F. pp. 111-130, 349-35. 1973.
4. TSEN, C. C. . Microwave energy for Bread Baking and its effect on \he Nutritive Value of Bread: A review. J. Food Prot. 43(8): 638-640. 1980.
5. HUI, J.L. Encyclopaedia of Food Science and Technology. Montreal, Canada Tomo: A-E Pag:211-218. 1991.
![]()
![]()
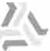
 uo ·--1)
uo ·--1)

 tiempos de inactivación para todas las muestras mostraron un patrón muy similar.
tiempos de inactivación para todas las muestras mostraron un patrón muy similar.