ULTRAESTRUCTURA DE LAS PAREDES CELULARES DE BASIOIOCARPOS DE
Agaricus blsporus
(CHAMPIÑÓN
COMÚN).
Concepción García Mendoza, Juan 1 Corujo
'
, Eloy Blanco y Monique Novaes-Ledieu.
Centro
de
I
nvestigaciones Biológicas, C.S.l.C.
,
Velázquez 144, 28006 Madrid, España.
RESUMEN
.
Preparaciones purificadas de paredes celulares de basidiocarpos de Agarícus bísporus fueron estudiadas mediante microscopia óptica (contraste
de fases) y electrónica (técnicas de cortes finos y sombreado) .Gracias a la solubílización gradual delos componentes sacarfdicos de dichas paredes ha
sido posible la ubicación de los mismos dentro de estas estructuras celulares. Asl, se ha podido comprobar que la capa externa corresponde al
polisacárido mucílago diferente de una zona fibrosa de a. g!ucano, debajo de la cual se sitúa la capa interna fibrilar de quitina, ambas cementadas por
P glucanos y a las que se asocian las protefnas.
INTRODUCCIÓN
.
Los hongos son organismos eucarióticos cuyas células contienen su material genético encerrado en núcleos separados del citoplasma por una membrana ,
distinta de la plasmática que recubre a la célula entera. Esta pared celular tiene dos funciones principales: proteger al protoplasto y suministrar la
forma caracter ística a la célula.
La pared celular está constituida por dos tipos de componentes: los estructurales o fibrilares y los componentes amorfos. Los primeros son los
responsables de la forma y rigidez de la pared y están constituidos mayoritariamente por glucanos y quitina. Glucanos del tipo a. y han sido
encontrados en las paredes celulares de varios grupos de hongos junto con quitina , esta última en forma de microfibrillas. Los componentes amorfos
(lfpidos. proteínas y diferentes tipos de polisacáridos) constituyen el material cementante que permite la organización de la pared celular y que
proporcionan mayor resistencia a la célula.
Una determinada clase de hongos. los basíodiomícetos superiores, producen en el momento de su reproducción sexual un tipo de estructur a aparente o
basidiocarpo , de textura generalmente carnosa y que posee un olor y un sabor muy característicos .
El
consumo de setas. nombre vulgar dado a los basidiocarpos, está asentado en todas las latitudes y
su valor alimenticio es mundialmente reconocido. En el género Agarícus encontramos la mayor parte de las especies comestibles. En Europa la
explotación comercial está casi completamente dedicada af Agaricus bisporus (champiñón común), lo que le da una gran importancia económica.
El A. bisporus tiene además Ja característica de formar basidios con sólo dos esporas,cada una de ellas con dos núcleos complementarios. Por
lo tanto,cada una de estas esporas puede desarrollar directamente un micelio secundario fértil, capaz por si mismo de producir setas, pero el hecho de
no disponer de esporas haploídes que desarrollen micelios monocarióticos impide en principio efectuar hibridaciones con el fin de conseguir cepas
nuevas con características combinadas.

11nvestigador adjunto, Centro de Investigación, Uníversidad La Salle

}
El interés del estudio de la composición y estructura de la pared celular de A. bisporus por la razón recién apuntada de ser un
modelo de basiodiomiceto excepcional en cuanto a su ciclo biológico. estriba en la posibilidad de obtener protoptastos con los cuales ya se pueden
separar los micelos homocarióticos y por tanto. proceder a la mejora genética de las cepas comerciales. Paralelamente, el conocimiento de la
arquitectura molecular detallada de la pared celular de cada cepa comercial suministrará una información muy precisa de cada una, lo que dará lugar a
la confección de una ficha de identidad y la futura protección
legal de las cepas comerciales.
MATERIALES Y MÉTODOS.
Obtención
y purificación de paredes celulares.
Para este trabajo de investigación hemos utilizado esporocarpos jóvenes de Agaricu s bisporus. habiendo eliminado
previamente las !amelas.
El micelio terciario que compone el carpóforo disgregado mediante una batidora "Braun" se sometió a una ruptura mecánica en un Omnimixer·sorval" modelo
17220, método que preserva casi totalmente la fracción sacarídica superficial denominada mucílago (1) rea zando todo el proceso en fria. Cuando la
ruptura es total, las paredes obtenidas se purificaron mediante lavados con NaCI al 1% para eliminar los ácidos nucleicos que podrían contaminar dichas
paredes y seguidamente se sometieron a varios lavados en agua destilada.
Se comprobó la limpieza de las paredes mediante su observación al microscopio de contraste de fases.
Las paredes celulares purificadas fueron desecadas en un liofilizador para posteriores análisis.
Fraccionamiento de la pared
celular.
Los diferentes componentes sacarídicos de las paredes celulares purificadas se solubilizaron de forma progresiva con el objeto de ubicar los mismos
dentro de la estructura de la pared, por lo cualse siguió el esquema que se describe en la Figura No.1 (2.3).
Microscopía electrónica.
Las paredes celulares sin tratar, así como las paredes residuales se observaron en el microscopio electrónico mediante las técntcas de cortes
ultrafinos y de sombreado.
En el primer caso, las muestras se fijan y tiñen con permanganato potásico al 2% durante 2.5 h. Seguidamente se lavan y se someten a deshidratación con
acetonas de concentraciones crecientes. utilizando como contraste una solución de acetato de uranilo en acetona . Posteriormente se incluyen las
muestras deshidratadas en una resina epoxi Araldita y se cortan en un microtomo Reichert Ultracut-E mediante cuchilla de vidrio. Por último, los cortes
obtenidos se tiñen con citrato de plomo y se observan en el microscopio electrónico.
En el segundo caso, se coloca una suspensión homogénea de las muestras sobre unas rejillas cubiertas con una película de soporte y vaporizadas
con carbón. .Evaporada el agua de éstas, se introducen las rejillas en el vaporizador, donde en condiciones de alto vacio se hace pasar una corriente
eléctrica con la que se desprenden de un filamento incandescente de la aleación Au-Pd partlculas finísimas que caen sobre la muestra con un determinado
ángulo, consiguiendo un sombreado perfecto.


F¡gura No.1 Fracdonamiento de pared celular
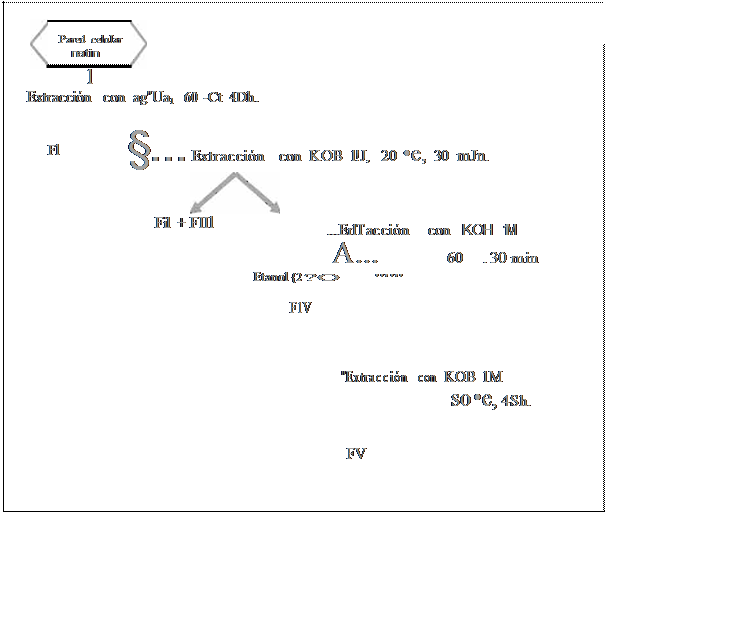
 FI: [\-glucano mucilaginoso Fii: a.-glucano estructural
FI: [\-glucano mucilaginoso Fii: a.-glucano estructural
Flll, FIV, FV: -glucanos cementantes
RESULTADOS Y DISCUSIÓN:
La Figura No.2 muestra una panorámica de la preparación de paredes celulares de basidiocarpos de
A.
bisporus
en el microscopio de contraste de fases.
Los cortes finos realizados en las preparaciones previamente fijadas con permanganato potásico de las paredes celulares totales y de las sucesivas
paredes residuales después de las extracciones descritas anteriormente se muestran en la Figura No.3.


Figura No.2
Preparación de paredes celUlan:!s de basidiocarpos de
A.
blsporos
en el microscopio de contraste de fases
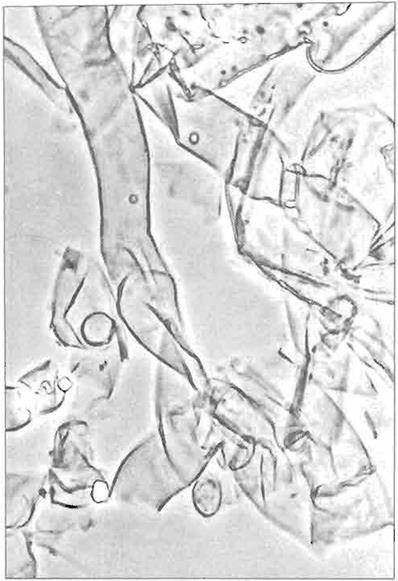 (X 1,600),
(X 1,600),
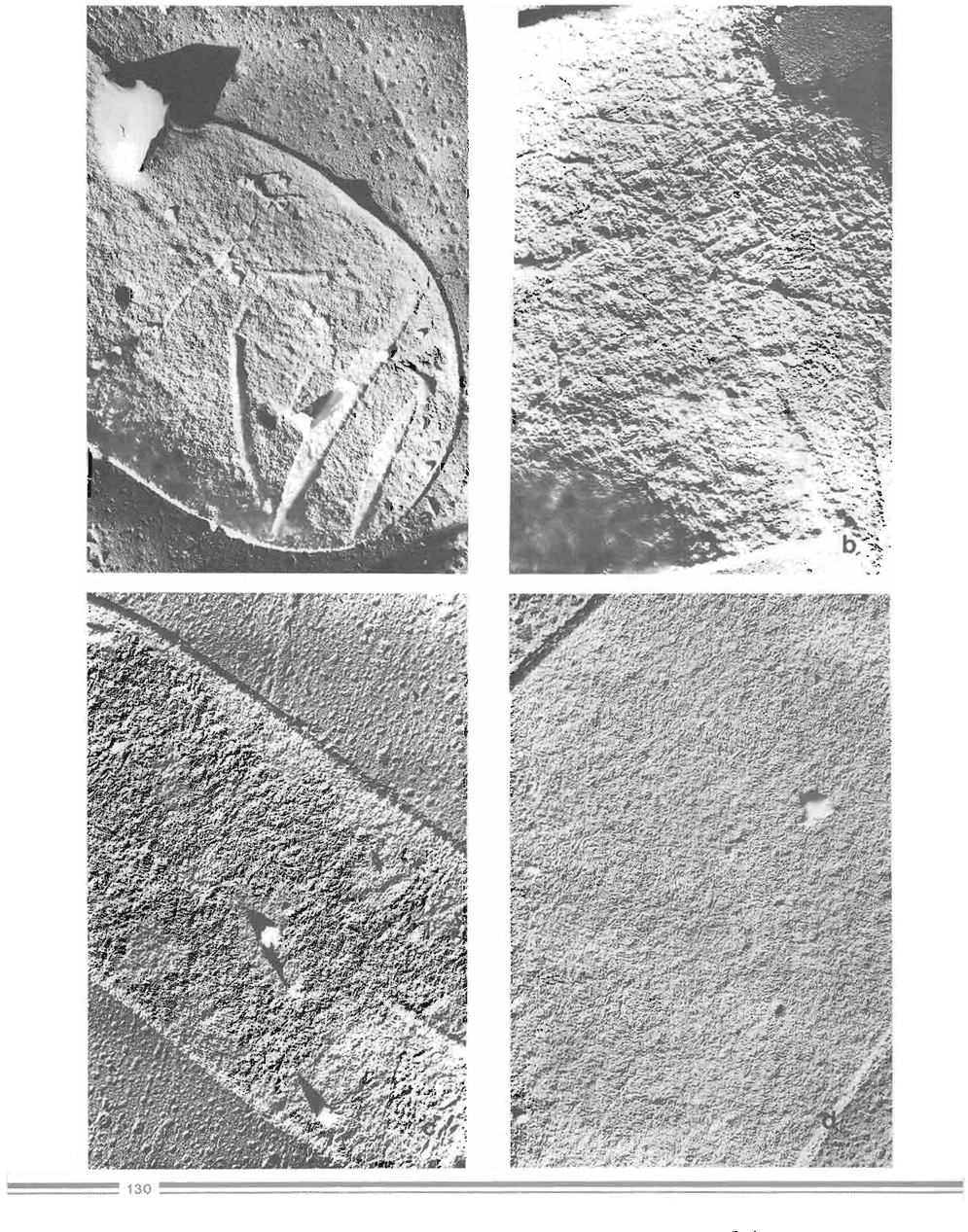
Las paredes celulares totales (Figura No. 3a) muestran aparentemente tres regiones diferentes: una z.ona externa a veces algo discontinua y más densa
al flujo de electrones; una capa interna igualmente densa separada por una región intermedia menos densa a dicho flujo. Las dimensiones de estas
regiones pueden variar entre las distintas hitas, pero el grosor medio de la pared se encuentra entre 80-100 nm. La superficie externa es discontinua y
corresponde al mucílago, polisacárido lábil poco ligado a dicha superficie (1).
El tratamiento de las paredes celulares con agua destilada a 60 ºC durante 40 h solubiliza el polisacárido mucllago (2). Cortes finos de estas
preparaciones muestran cómo desaparece prác1icamente toda la capa externa densa a los electrones (Figura No. 3b).
Cuando las pa redes celular es pretratadas se extraen con KOH 1N a 20ºC durante 30 min y a continuación a 60ºC igualmente por 30 min, se van
produciendo variaciones en el grosor y apariencia de dichas paredes celulares (Figura No. 3c). de tal forma que se han extraído progresivamente a.. y glucanos ubicados desde la parte externa hacia la zona media de la pared celular (3) .
El tratamiento final de las paredes residuales con KOH 1N a 60ºC durante 48 h solubiliza la mayor parte del p glucano cementante (Figura No.
3d}, dejando un residuo final de pared compuesto por quitina y un remanente de glucano insoluble (2).
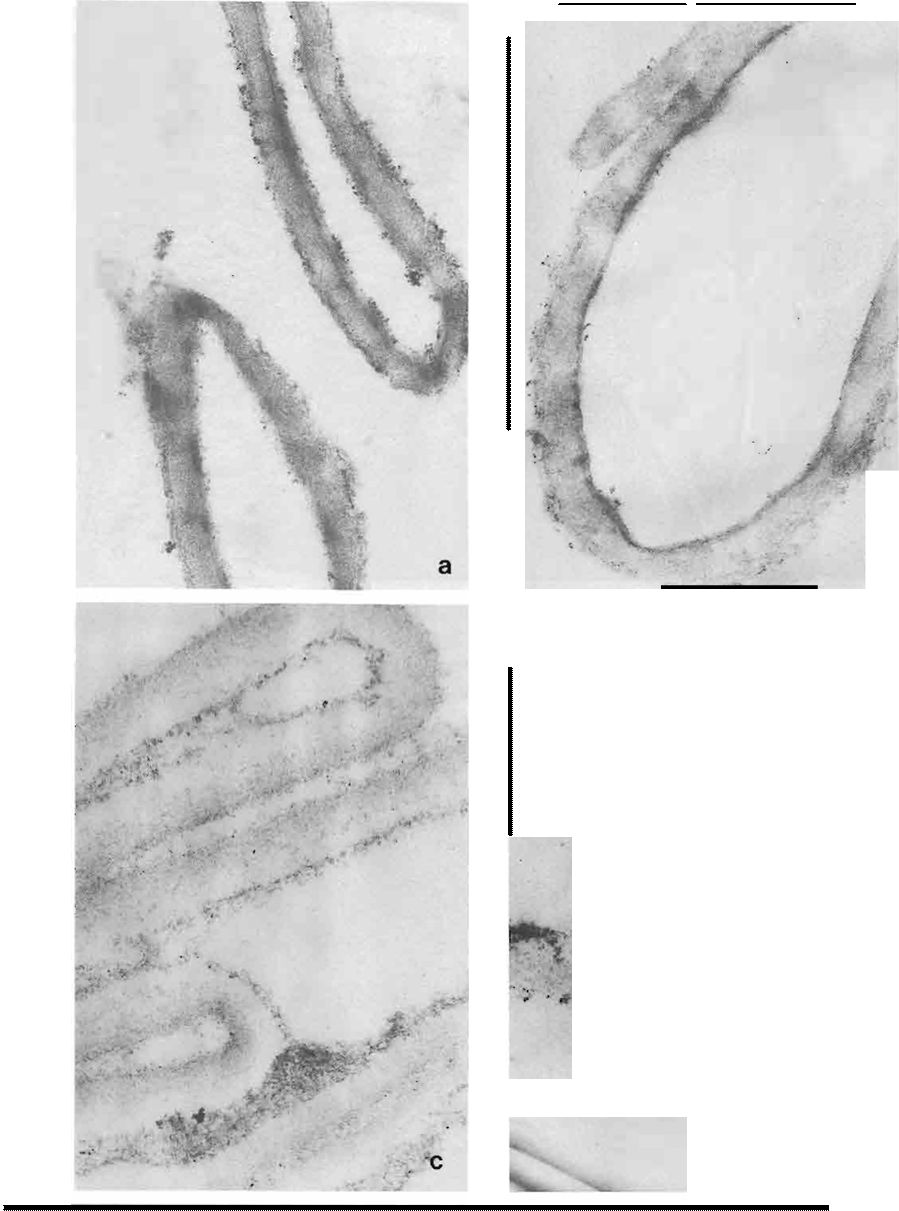
Las mismas preparaciones descritas observadas mediante la técnica de sombreado se muestran en la Figura No. 4 . Las paredes celulares completas exhiben
una superficie granulosa que corresponde al mucílago (Figura No. 4a) en la que en algunas preparaciones se vislumbran unas fibras subyacentes que
corresponden al a. glucano (4). Cuando se elimina esta capa de fibras grandes. en genera! orientadas a
lo largo de la hifa (Figura No. 4b), se observa la aparición de fibrillas de menor tamaño orientadas al azar, entrelazadas y con tendencia transversal
que corresponden a la quitina cementada con mayor o menor porcentaje de p glucano (Figuras No. 4c-d).

Figura No.3. Cortes finos de las paredes celulares completas y sucesivas paredes residuales de A.
bisponis
{a x 30,000 ¡ b x 40,000 ¡ e x 50,000; d x 40,000)

 ...
...
;.-
. •
, _. .... .
• ......
d

La ultraestructura general de las paredes celulares de basidiocarpos de A. bísporus que acabamos de describir se corresponde en gran manera
con la de otros basidiomicetos estudiados (5,6.7) y corrobora las observaciones de Mol et al (8) realizadas en paredes de estípites de A. bísporus , así como las de micelio vegetativo del mismo organismo (4,9).
Esta particular arquitectura de las paredes celulares de basídíomicetos superiores comprendiendo una serie de capas más o menos definidas de mucílago
externo, seguida de et glucano y glucanos y quitina (incluyendo entre ellas las proteínas) se corresponde de alguna forma con las bandas detectadas en los cortes teñidos con KMnO, y se comprueba gracias a las preparaciones de paredes totales y sus diferentes paredes residuales
mediante la técnica de sombreado.
La diferente orientación de las fibras y su interacción con el material cementante confiere a la pared celular un amplio margen de propiedades
mecánicas y plásticas necesarias para su diferenciación y morfogénesis a lo largo del complejo ciclo biológico de A. bisporus.
CONCLUSIONES.
La ultraestructura de las paredes celulares de basidiocarpos de Agaricus bísporus que acabamos de describir se organiza de forma prácticamente
semejante a la de otros basidiomicetos superiores estudiados; es decir, en una sucesión de capas de polisacáridos fibrilares y cementantes que le
confieren propiedades especificas .
La particular ultraestructura de los componentes polisacaridicos,junto con la estructura química de cada uno de ellos. permitirá la confección de una
ficha de identidad de las distintas cepas comerciales. base documental para su posterior protección legal.
REFERENCIAS.
1. Avellan, M.A., García Mendoza, C. y Novaes-Ledieu, M. (1986)."Relationship between the presence of wall mucilage and the cellular dísruptíon method
employed in Agaricus bisporus terciary mycelium''. FEMS Microbio!. Lett. 34:101-104.
2. García Mendoza, C.. Avellan. M.A., Sánchez, E. y Novaes-Ledieu, M. (1987) . "Oífferentiation and wall chemistry of Agaricus bisporus
vegetative and aggregated mycelia". Arch Microbio!. 148: 68-71 .
3. Novaes-Ledíeu, M., Martlnez Cobo, J.A. y García Mendoza. C. (1987). "The structure of the mycelial wall of Agaricus bísporus".
Microbiología SEM. 3: 13-23.
4. Garcia Mendoza. C., Sánchez, E. y Novaes-Ledieu , M. (1987). "Ditferences in microfibrils in the walls of Agaricus bisporus secondary
mycelium". FEMS Microbio!. lett. 44 : 161-165.
5. Carbonell, L.M., Kanetsuna, F. y Gil, F. (1970). "Chemical morphology of glucan and chitin in the cell wall of the yeast phase of Paracoccídiodes brasiliensís" . J. Bacteriol. 101: 636-642.
6. Hunsley,D.y Burnett. J.H. (1970). 'The ultrastructural architecture of the walls of sorne hyphal fungí". J. Gen. Microbio!. 62: 203-218.

Figura No.4. Sombreados de las paredes celulares completas y sucesivas paredes residuales de A.
bisporos
{a x 12,000 ; b x 16,000; e x 12,000; d x 16,000).


7. Kamada, T., Hamada. Y., y Takemaru, T. (1982). "Autolysis ín vitro of the stipe cell in Coprinus macrorhizus ".J. Gen. Microbio!. 128: 1041-1046.
8. Mol, P.C.. Vermeulen, C.A. y Wessels, J.G.H. (1990). "Díffuse extension of hyphae in stipes of
Agarícus bísporus
may be based on a unique wall structure". Mycol. Res. 94: 480-488.
9. Michalenko, G.O., Hohl, H.R. y Rast, D. (1976). "Chemistry and architecture of the mycelial wall of
Agaricus bísporus".
J. Gen. Microbio!. 92: 251-262.
![]()
![]()

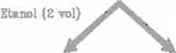 FI: [\-glucano mucilaginoso Fii: a.-glucano estructural
FI: [\-glucano mucilaginoso Fii: a.-glucano estructural
 (X 1,600),
(X 1,600),
 ...
...