![]()
![]()
DETERMINACIÓN SIMULTÁNEA DE ÁCIDO NICOTÍNICO, NICOTINAMIDA, TIAMINA Y RIBOFLAVINA EN PRODUCTOS DE ORIGEN ANIMAL Y VEGETAL POR HPLC
I rene Montalvo 1 Etelblna Molina y Carolina P. Candedo
Centro de Investigación y Escuela de Ciencias Químicas, Universidad La Salle
RESUM EN
Debido a que las vitaminas deben estar presentes en el alimento para que las proteínas, grasas y carbohidratos puedan ser metabolizados y aprovechados por el organismo, en este trabajo se propuso un método para la cuantificación simultánea de ácido nicotínico, nicotinamida, piridoxina, tiamina y riboflavina en alimentos de origen vegetal y animal por Cromatografía de Liquidas de Alta Resolución (HPLC). Los resultados mostraron diferencias al compararlos con los valores dados en tablas de composición alimenticia, debido a que se trata de compuestos sensibles a cambios por factores físicos y químicos como luz. temperatura, pH, cantidad de oxigeno disponible, y a factores propios de los
alimentos como cosecha, manejo, almacenamiento y procesamiento de los alimentos, e inclusive a diferencias en el resultado por la metodología usada para su cuantificación. El método propuesto se puede utiliz.ar con resultados confiables para la determinación de ácido nicotínico, nicotinamida, tia(nina y riboflavina.
ABSTRACT
As vitamins should be whithin the foods in order to metabolize proteíns. fats and carbohydrates and then be able to be used by the organism, the curren!studies proposed a method for the simultaneous measurement of nicotinic acid, nicotinamide, piridoxine, tiamine and riboflavine in foods from vegetal and animal source by High Performance Liquid Chromatography (HPLC). The results showed differences whith the food composition value tables because vitamins are compounds sensitive to both physic and chemical changes as light, temperature, pH, quantity of oxigen available , and self-facts of the foods as harvest, handling, storage and processing, and a!so differences in results because of the methology used for the measurement. The proposed method could be used with confidence in the quantification of nicotinic acid, nicotinamide, tíamine and riboflavine.
INTRODUCCIÓN
Los estudios sobre la alimentación humana en el siglo pasado llegaron a una fórmula exclusivamente "cuantitativa" de la propia alimentación, en el sentido de que, de acuerdo a J a edad y a !as condiciones de trabajo y fisiológicas del individuo, se establecían las necesidades energéticas mínimas, o sea, las calorías que debían contener los a limentos ingeridos durante las 24 horas, y que al metabolizarse estos alimentos, desarrollaran la energía necesaria para mantener al organismo
con vida. Siempre que este mínimo de energía fuera mantenido, se consideraba indistinto que fuera obtenido de grasas, proteínas o carbohidratos: por lo tanto, se creía que estos principios nutritivos podían sustituirse entre sí (1- 3).
Posteriormente, se observó que ciertas sales minerales (hierro, calcio, sodio, potasio, fósforo. etc.) a pesar de no ser indispensables desde el punto de vista de la producción de energia. deben estar presentes en los alimentos en cierta cantidad y proporción recíprocas, ya que su carencia o aporte desequilibrado comprometen tanto el crecimiento y e! recambio de ciertos tejidos (por ejemplo, los huesos) como el equilibrio ácido-básico de los humores orgánicos (sangre, linfa intersticial de los tejidos, etc.).
Finalmente, se comprobó que ni una dieta completa en grasas. carbohídratos, proteínas y sales minerales lograba satisfacer todas las necesidades del organismo. haciéndose patente que para mantener la salud. la dieta tiene que contener otros compuestos orgánicos (3-5).
E! reconocimiento de este hecho, se basó en una serie de observaciones, de las cuales se
![]()
![]()
dedujo que los alimentos naturales contenían sustancias indispensables para la salud que no eran proteínas, grasas ni carbohidratos. En 1906,
F. G. Hopkins llamó a estas sustancias "factores alimenticios accesorios" y en 1911 c. Funk introdujo el término "vitaminas'', suponiendo que
eran aminas necesalias para la vida. Este término es actualmente erróneo ya que no todas las vitaminas tienen estructura de amina, aunque el uso de este término se ha generalizado para designar a este grupo de compuestos orgánicos (1,4,6).
Las vitaminas pueden definirse como sustancias organicas indispensables en cantidades cataliticas para el funcionamiento normal de tas células vivas, así como para su crecimiento y equilibrio. cuya síntesis en proporciones adecuadas no puede realizar el organismo, por lo que se requiere ingerirlas en la dieta diaria, aunque hay algunas excepciones como el caso del ácido fólico, biotina y vitamina K, que la flora bacteriana del intestino puede sintetizar. En general, su función principal es participar en el control de las actividades enzimáticas como coenzimas y cofactores a nivel de todas las vías del metabolismo.
Las vitaminas no pertenecen a un grupo específico de compuestos. son generalmente complejas en su estructura química y muy diferentes entre si. Debido a esto, no se han podido clasificar con base a su estructura o composición química; sin embargo, se han clasificado de acuerdo a su solubilidad, y asf tenemos a las vitaminas liposolubles A, O, E, y K y a las hidrosolubles: e, 81 (liamina), 82
(liboflavína), 66 (piridoxina), niacina. ácido fólico, ácido pantoténíco, biotina, B12 (cobalamina). etc. (7).
A pesar de su requerimiento mínimo, su importancia radica en los efectos biológicos, ya que si durante algúntiempo faltan o escasean las vitaminas en la dieta, surgen en el organismo estados patológicos específicos, asf como también numerosos transtomos de una o varias funciones metabólicas, ya que las vitaminas sin intervenir directamente como material de
transformación (sustrato), activan múltiples reacciones bioquimicas sin las cuales no es posible la vida en ningún organismo (3).
La mayoría de los métodos que existen para cuantificar vitaminas como los colorimétricos. fluorométricos, microbiológicos e inclusive
animales, son costosos. largos y difíciles, además de que su cuantificación es de focma individual. Dado esto. es importante contar con una metodología que nos permita determinar de manera rápida y confiable el contenido de algunas de estas vitaminas contenidas en los alimentos.
OBJETIVOS
• Establecer un método de hidrólisis para la extracción de ácido nicotínico, nicotinamida. piridoxina. tiamina y riboflavina en alimentos de origen animal y vegetal.
Determinar simultáneamente las vitaminas mencionadas anteriormente , por HPLC.
Cuantificar estas vitaminas en alimentos de origen animal y vegetal.
METODOLOGÍA
En el presente trabajo se analizaron de manera simultánea ácido nicotinico, nicotinamida. piridoxina, tiamina y riboflavina por HPLC tomando como base para la separación de estos compuestos varios métodos ya descritos en la bibliografía (8,9): además, se probaron los métodos de hidrólisis para la separación de las vitaminas en alimentos de origen animal (1O) y vegetal (11). Para dichos análisis se tomaron en cuenta las propiedades químicas que tienen en común estos compuestos , ya que su separación fue de forma simultánea, como son: a) su estabilidad en soluciones ácidas diluidas y b) su estabilidad al ox{geno atmosférico y al calor.
Para la identificación de las vitaminas y su cuantificación posterior en las muestras de estudio. se utilizaron estándares de cada una de las vitaminas. los cuales se sometieron de manera individual y simultánea a las condiciones de hidrólisis tanto vegetal como animal, dependiendo del origen de las muestras que se iban a cuantificar con ese estándar, con el objeto de identificar el tiempo de retención de cada una
de las vitaminas y para eliminar las pérdidas que
se tienen de estos compuestos por el proceso de hidrólisis. Después se sometieron de igual forma al análisis cromatográfico , conociendo así el tiempo de retención y el área correspondiente a la concentración utilizada de cada vitamina.
![]()

La hidrólisis de las muestras se llevó a cabo de acuerdo a los métodos descritos por Dawson y col. (1O) (para muestras de origen animal) y por Torna y col. (11) (para muestras de origen
vegetal), como se había dicho anteriormente. Las
condiciones cromatográficas que se aplicaron para la separación y cuantificación de las vitaminas analizadas fueron las siguientes:
• HPLC marca Varian, Modelo 5000, con Vista
401 y detector UV de longitud de onda variable.
• Columna de acero inoxidable u-Bondapak C18 (octadecilsilanos), de 4 x 300 mm de longitud.
• Fase móvil: metanol:agua: PIC B-6
(25:75:0.01M)
• Velocidad de flujo: 0.8 ml/mín.
• Detector: UV a 254 nm.
RESULTADOS Y DISCUSIÓN
Con las condiciones cromatográficas descritas, se obtuvieron los resultados expresados en las Tablas 1y 2. El valor obtenido para las vitaminas analizadas en las muestras de estudio puede ser diferente al obtenido en otros trabajos para los mismos alimentos, e inclusive de los que se tomaron como referencia (tablas de composición de alimentos) . ya que en éstos pueden influir las condiciones de cosecha . tipo de suelo, manejo y almacenamiento de los alimentos,etc. otro factor que se debe considerar en la variabilidad de concentración de las vitaminas en las muestras analizadas, es la metodología utilizada para la cuantificación, ya que existen diferencias en los procesos de extracción, purificación y en la detenninación mísma, que afectan los resultados finales.
Es importante considerar que las vitaminas son compuestos muy sensibles a los factores físicos y químicos. La estabilidad de las vitaminas en estudio es determínante en el contenido vitamínico dentro de un alimento (12).
En nuestro caso, las muestras fueron obtenidas de mercados y supermercados, dentro de los cuales, en el manejo de los alimentos no se tienen las suficientes precauciones. por lo que la pérdida de vitaminas desde la producción del
alimento hasta el momento de hacer la determinación puede ser considerable. Además, algunos de los alimentos estudiados , están expuestos totalmente a la luz y al oxigeno par no estar protegidos por algún empaque, o algunos
RevCentro 1nv . (M6x) Vol 3 Nt!m 9 (1997)
otros utilizan empaques que sólo penniten una protección parcial debido a que son transparentes. por lo que se puede dar en cierto grado la degradación fotolítica en estos productos, y de esta manera bajar la concentración de las vitaminas.
Cuando los alimentos entran en contacto con el agua, por ejemplo, en el lavado y transporte. ocurre una lixiviación de las vitaminas: lo mismo ocurre durante el descongelamiento de productos como carnes y pescados, en cuya agua de descongelamiento se arrastran vitaminas hidrosolubles. Además, en la pérdida de vitaminas influyen otros factores como es temperatura, pH, cantidad de agua, área expuesta, madurez del alimento, disponibilidad de oxígeno, luz, etc. (3).
En el caso de los alimentos procesados. debe considerarse la posibilidad de que el tratamiento térmico aplicado en el proceso haya sido excesivo, lo que puede causar disminución del contenido vitamínico.
El ácido nicotinico se encuentra principalmente en alimentos de origen vegetal, mientras que en los alimentos de origen animal se encuentra la nicotinamida, lo que concuerda con lo obtenido en este trabajo (13). En los resultados se observa que fue precisamente el ácido nicotíníco, la vitamina que presentó mayor similitud con los valores de referencia de muestras vegetales y la nicotinamida en muestras animales.
En la cuantificación de la riboflavina. tanto en muestras de origen vegetal como animal, se observa una tendencia a obtener datos más elevados que los de referencia; en cambio, en el caso de la tiamina , tanto en muestras de origen vegetal como animal, presentó una tendencia menor a obtener valores cercanos a los de referencia, esto puede explicarse a que, debido a su estructura química, la tiamina es una de las vitaminas más inestables.
La determinación de las vitaminas en estudio pudo encontrar ciertas limitaciones en las muestras de origen animal, atribuidas a su propia
naturaleza. ya que se informa en trabajos anteriores que cuando se trabaja con matrices complejas. la HPLC no es adecuada para la determinación de riboflavina y tiamina, debido a que las condiciones experimentales y la eliminación de interferencias causadas por la
27

![]()
Tabla 1.Oetenninación de ácido nicotinico, riboflavina y tíamina en alímentos de origen vegetal
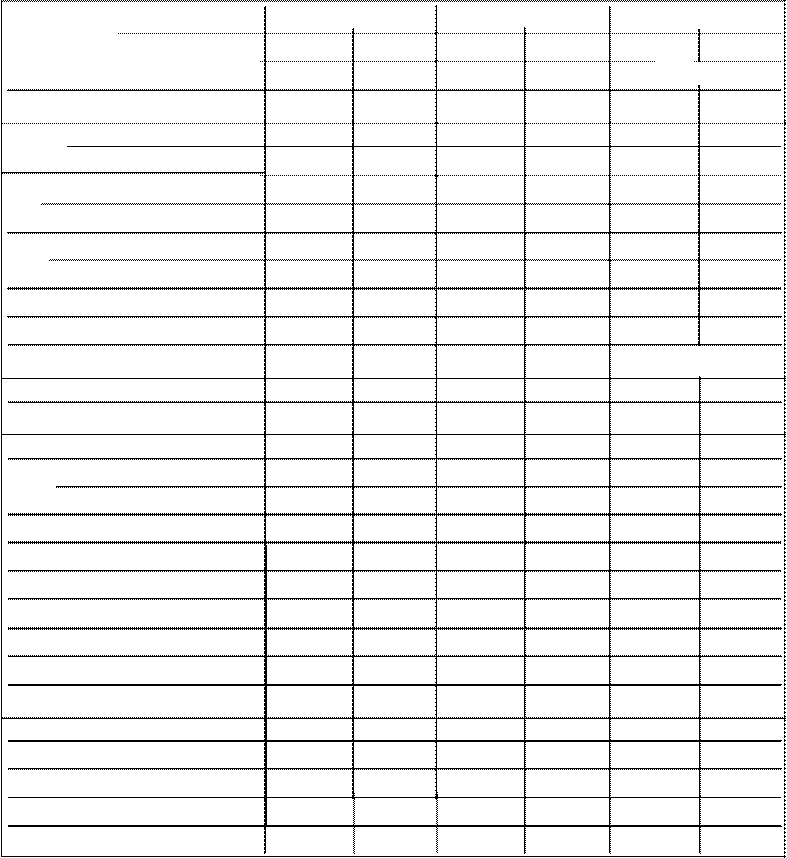 (mg /100 g de muestra).
(mg /100 g de muestra).
AC NICOTINICO TIAMINA RIBOFLAVINA
M U E S T R A Exoerim. Teóríco1 Exoerim. Teórico1 EXPerim. Teórico 1
Harina refinada de triao ----- 1.00 0.60 0.18 0.16 0.20
Harina intearal de trigo 1.26 1.60 1.18 0.38 0.65 0.08
Harina de maíz 2.14 1.30 0.46 0.22 0.68 0.05
Harina de soya desengrasada 5.29 1.60 4.25 0.70 0.87 0.10
Pan de caia blanco 3.85 3.30 0.77 0.10 0.17 0.06
Pan de caia inteoral 2.09 1.10 0.77 0.19 0.63 0.13
Pan tostado 1.19 1.70 ---- 0.20 0.37 0.28
Pan de caía de centeno 0.61 NR 0.76 0.19 ---- 0.08
Bolillo 0.43 1.00 0.54 0.26 0.19 0.06
Sooa tipo esoaauetti 0.51 1.1o 1.66 0.12 0.32 0.08
Sopa de letras 0.86 1.10 0.81 0.12 0.37 1 0.08
Sooa de fideo 1.41 1.10 0.46 0.12 0.19 0.08
Hojuelas de maíz <Kelloa's) 2.38 NR 0.77 NR 0.86 NR
Hojuelas de maíz (Nestlé) 5.76 NR 1.21 NR 0.95 NR
Cereal de arroz para desayuno 3.70 NR 1.32 NR 0.70 NR Hoiuelas de avena ---· NR 0.75 NR 0.39 NR Avena en orano 1.30 0.80 0.81 0.53 0.55 0.11
Cebada en grano 1.33 4.80 1.03 0.38 0.42 0.20
Malz amarillo en grano 0.93 1.60 0.72 0.43 0.31 0.10
Maíz blanco en grano 1.58 1.90 0.97 0.43 0.68 0.10
Triao en arano 1.29 4.40 2.29 0.59 0.37 0.22
Trigo germinado 0.98 NR 0.42 NR 0.52 NR
Frijol 1.19 2.30 0.84 0.80 0.22 0.14
Garbanzo 2.21 1.5 0.46 0.74 0.32 0.17
Haba 2.05 2.30 2.90 0.91 0.52 0.31
Lenteja 2.32 2.00 0.52 0.69 0.30 0.33
Alverjón 1.75 2.30 2.20 0.90 0.42 0.18
Sova 2.22 NR 1.88 0.88 1.71 0.27
'Fuentes: 16 y 17
NR Dato bibliográfico no reportado
---· No cuantificado
![]()

Tabla 2.Determinación de nicotinam1da, nbonavina y tiamina en alimentos de origen animal
(mg/100 g de muestra).
![]()
1 AC . NICOTINICO
TIAMINA RIBOFLAVINA
_M_U_E S T R A
--------1 --- --- ---,-.--
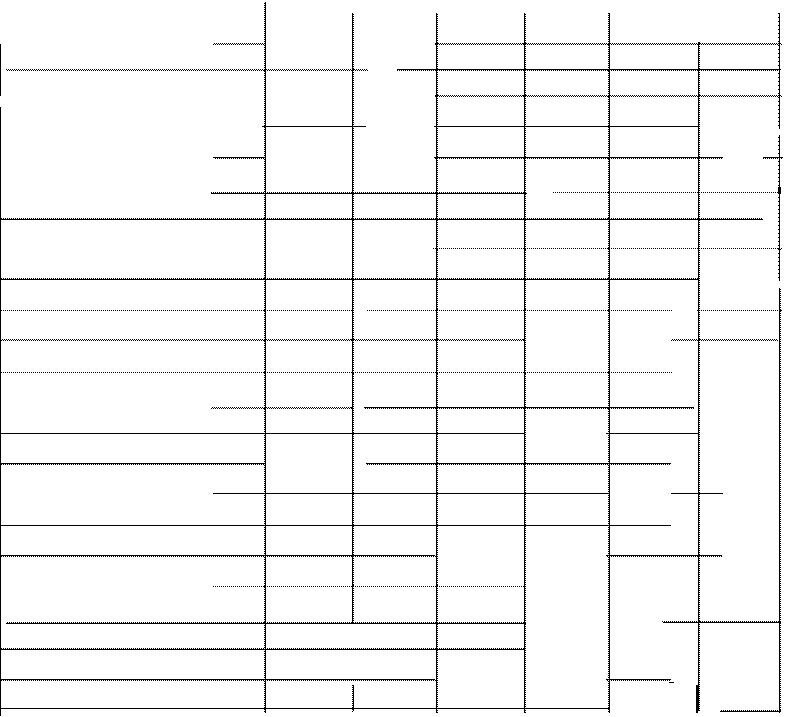
|
Experim. Teórico 1
E xperim. Teórico1
![]()
![]() t
t
Leche entera líquida 0.13 0.10 ---- 0.04 0.20
1 0.09
Leche entera en polvo 1.26 0.10 -·-- 0.36 0.51 1.87
-Leche descremada líquida
- 0.18 NR ---- NR 0.80 NR
Leche descremada en polvo 0.44 0.30 1.07 0.20 0.28 0.96
|
Leche evaporada 0.30 0.10 ........ 0.06 0.16 0.32
Leche condensada 1.62 0.20 0.69 0.08 0.52 0.40
Yogurth 0.18 NR 0.21 NR 0.12 NR -
Queso crema 0.07 NR ......... NR -- NR
Queso fresco 0.09 0.10 0.68 0.02 0.29 0.24-
|
fo
Queso gruyere 0.14 NR 0.19 NR -
0.20 NR
Jamón 2.80 3.60 0.33 0.64 0.17
-0.17
Chorizo 3.08 4.60 0.39 0.59 0.18 0.26
-Salchicha 0.21 NR ---- NR -
1.14 NR .
Mortadela
-0.57 NR ----- NR ---
- NR
Huevo 0.10 0.10 0.79 0.14
- 0.63 0.37
Carne de res 8.57 2.90 0.94 0.07 0.16
-0.20
Pescado 0.43 0.90 0.37
-0.35 0.19 0.07
Pollo 9.15 9.00 0.29 0.08 ......... 0.16
1- -
Carne de cerdo 6.87 4.00 0.29 0.85 0.17 0.22
Hígado de cerdo 4.97 13.70 0.47
Hígado de pollo 5.64 1 5.20 0.59
.. 0.29 0.38
. 0.12 0.42
. 2.55
-0.91
Lengua 3.03 3.10 0.25 0.08 0.27
1Fuentes: 16 y 17
NR Dato bibliográfico no reportado
---- No cuantificado
. 0.31

![]()
compleja matriz en la que se encuentran, no han sido investigadas en detalle (14).
En general,se puede decir que las muestras presentaron valores muy altos en comparación con los valores de referencia, esto puede indicar que su pico de absorción pudo sufrir interferencias con algún otro compuesto soluble que se encontraba en la muestra. y cuya longitud de onda esté muy cercana a la de la vitamina en estudio, por lo que se pudieron empalmar los picos. obteniendo valores más elevados, lo que sugiere que se debe hacer una limpieza profunda de la muestra para evitar sustancias de interferencia y de esta manera aumentar la sensibilidad de la detección.
En caso contrario, en las muestras donde se obtuvieron valores demasiado bajos para las vitaminas estudiadas, o en las que no se detectó nada a pesar de que sí existe el dato teórico correspondiente, pueden indicar que:
• el contenido real de las vitaminas sea tan bajo que no pudo ser detectado.
• el contenido real sea bajo y por falta de una buena sensibilidad de la técnica no se haya podido detectar.
Originalmente. en este estudio también estaba incluida la determinación simultánea de la piridoxina, pero finalmente ésta no se informa, ya que los datos experimentales de las muestras analizadas no fueron aceptables. Se ha publicado en otros estudios que el análisis de la piridoxina representa un problema analitico, debido a que los vitámeros de esta vitamina existen de manera conjunta en niveles muy bajos. Debido a la composición compleja de los alimentos, es claro, que las determinaciones confiables de piridoxina requieren elevada eficiencia cromatográfica, al igual que una elevada sensibilidad en la detección, así como una especificidad excelente, por lo que utilizando condiciones iguales para la determinación simultánea de las vitaminas en estudio , lo anterior no se logró con el diseño cromatográfico que se propuso (15).
Con respecto a los métodos de hidrólisis para ambos tipos de muestras a liment icias, fueron adecuados, ya que a excepción de la piridoxina, sí se tuvo separación y cuantificación de las otras vitaminas. Se realizaron pruebas de recuperación con vitaminas estándar que se sometieron a hidrólisis idénticas que las muestras, y se obtuvieron valores de alrededor del 98% para
ácido nicotínico, nicotinamida. tiamina y riboflavina, con lo cual se comprobó que éstas no sufrieron daño significativo por el proceso de hidrólisis.
CONCLUSIONES
Los métodos cromatográficos han sido utilizados para obtener y mejorar la determinación simultánea de diferentes·vitaminas, sin embargo, el principal problema es la estandarización de las
condiciones de extracción. tomando en cuenta las características ffsicas y qufmicas de los alimentos y la estabilidad de las vitaminas que van a ser analizadas.
Es importante tomar en cuenta que, a pesar de que la HPLC es una técnica aparentemente sencilla. son muchos los factores que deben considerarse para tener una separación adecuada de los componentes que se desean analizar, como son. naturaleza del alimento, tipo de columna y empaque . modo de cromatografía , concentración y componentes de la fase móvil y estacionaria, tipo de detector, etc.
El análisis simultáneo presenta ciertas limitaciones, como es el hecho de que las muestras deben contener alrededor de la misma cantidad de cada una de las vitaminas analizadas. así se asegura que la cantidad de vitamina sea lo suficientemente adecuada para su determinación, lo cual no sucedió en este trabajo, ya que se analizaron muestras con cantidades de vitaminas muy variables.
Otra limitación, es que al proporcionar condiciones intermedias para las vitaminas como son los métodos de hidrólisis simultáneos, o una longitud de onda intermedia para la detección. algunas de estas vitaminas no se encuentran en el rango apropiado para su análisis. como sucedió con la piridoxina.
Al igualque en otros informes, en este trabajo se propone una metodología que sirve de base para la determinación simultánea de niacina. riboflavina y tiamina en alimentos de diversos orígenes.
REFERENCI AS
1. Lloyd, L.E. Fundamentos de nutrición.
España. Acribia p. 464, 1982.
![]()

2. Davidson, S. Human nutrftion and dietetics. 7th. Ed. Londres. Churchill Livingston pp. 117- 293, 1979.
3. Badui, S. Qulmica de los alimentos. 2a. Ed.
México. Alhambra p. 648, 1990.
4. Bender, A.E. Nutrición y alimentos dietéticos. 2a. Ed. España. Acríbia p. 258. 1987 .
5. Methods of vitamin assay. 4th. Ed. Prepared and editéd by The Association of Vitamin Chemists, lnc. Methods Committee. USA. lnterscience Publishers 1969.
6. Cheftel, J.C. Introducción a la bíoqulmica y tecnología de los alimentos. Vol. 11. España. Acribia p. 404, 1989.
7. Manz.ur. A. y Harrow. B. Textbook of bíochemistry. 10th. Edit. USA. lnteramerican Saunders Company p. 725. 1971.
8. Dong, M.H. Thiamin, riboflavin and vitamin 86 contents of selected foods as served. J. Amer. Diet. Assoc. 76: 156-160, 1980.
9. McBride, O.E. y Wyatt, C.J. Evaluation of a modified AOAC deterrnination for thiamin and riboflavin in foods. lnstitute of Food Technologists. reprinted form J. Food Scí. 48: 748-750, 1983.
10. Dawson, K.R. HPLC Oetermínation of riboflavin, niacin and thiamín in beef. pork and lamb after alternate heat-processing methods. J. Agríe. Food Chem. 36: 1176- 1179, 1988.
11. Toma, R.B. y Tabekhia, M.M. High performance liquid chromatographic analysis of 8-vitamins in rice and rice products. J. Food Scí. 44: 263-265, 1979.
12. lnstítute of Food Technologists. Effects of food processing on nutritive values. A scientific statu summary. Food Technol. 49: 109-116, 1986.
13. De Leenheer, A. Modern chromatographic analysis of vitamins. Chromatographíc Science Series. Vol. 60. 211d. Ed. USA. Dekker p. 575, 1992.
14. Rizzolo. A. y Polesello, s. Chromatographic determination of vitamins in foods. J. Chrom. 624: 103-152, 1992.
15. Tryfiates, G.P. y Sattsangi, S. Separation of vitamin 86 compounds by paired-ion high performance liquid chromatography. J. Chrom. 227: 181-186, 1982.
16. Hernández, M. et al. Valor nutritivo de los alimentos mexicanos. Publicaciones de la División de Nutrición L-12. 10a. Ed. México. Instituto Nacional de la Nutrición. 1987.
17. Tabla de composición de alimentos para uso en América Latina. Instituto de Nutrición de Centro América y Panamá (INCAP). México. lnteramericana, 1966.