Introducción
La sepsis neonatal es una urgencia que se caracteriza por una infección sistémica secundaria al crecimiento de microorganismos en la sangre del neonato y representa la segunda causa de mortalidad en recién nacidos en México (Seale et al., 2014; Lozano-Ascencio et al., 2005). Estas infecciones reflejan la falta de madurez del sistema inmune (ej., disfunción de neutrófilos, linfocitos T y macrófagos) de los neonatos (Tsafaras et al., 2020; Singh et al., 2022).
La identificación del microorganismo causal y la administración de antibióticos juegan un papel fundamental en el tratamiento de la sepsis neonatal. La administración de antibióticos debe ser rápida, incluso en el contexto de falta de resultados microbiológicos (Fleiss et al, 2023). Sin embargo, la multirresistencia a antibióticos y la falta de conocimiento de la epidemiología local pueden limitar la aplicación de antibióticos efectivos (Sands et al., 2022; Patel et al., 2010). Más del 90% de los datos epidemiológicos actuales acerca de la sepsis neonatal se generan en países desarrollados, mientras que solo el 10% de los datos se generan en países de ingresos bajos o medios, como México (Pérez et al., 2015). Por lo tanto, hay un déficit de información epidemiológica en nuestro país, se desconocen cuáles son los microorganismos más comunes que afectan a la población y sus patrones de resistencia.
Clásicamente, las enterobacterias son la causa más común de sepsis neonatal en países en vías de desarrollo, mientras que los bacilos gram negativos son la etiología más común en Estados Unidos (Shane et al., 2013). Un estudio realizado en Guadalajara, México, reportó que los bacilos gram negativos representan el 72% de las bacterias identificadas en hemocultivos de pacientes con sepsis neonatal (ej., Escherichia coli y Klebsiella pneumoniae) (Pérez et al., 2015). En nuestro hospital, desconocemos los agentes causales más comunes que producen sepsis neonatal.
La tasa de positividad de hemocultivos en pacientes con sepsis neonatal es limitada. De hecho, algunos estudios han reportado que la incidencia de la sepsis neonatal con cultivo positivo es baja. En consecuencia, hay 6 a 16 veces más pacientes con sepsis neonatal y hemocultivos negativos (Klingenberg et al., 2018). También se ha descrito que la sepsis neonatal tiene un patrón estacional, es decir, el riesgo de sepsis neonatal cambia a lo largo de los meses o estaciones del año (Gudayu et al., 2019).
En este contexto, se desconoce la epidemiología local de los microorganismos más comunes que producen sepsis neonatal, el patrón de resistencia, ni las variaciones estacionales de la tasa de positividad de los hemocultivos durante el año. Por lo tanto, el objetivo del estudio es describir los aislamientos microbiológicos, los patrones de resistencia y la tasa de positividad de hemocultivos (sepsis neonatal con cultivo positivo versus negativo) durante un año en pacientes con sepsis neonatal en un hospital de segundo nivel en la Ciudad de México.
1. Material y métodos
Se realizó un estudio observacional, descriptivo y retrospectivo que se llevó a cabo en el Hospital Regional ‘General Ignacio Zaragoza’ del ISSSTE, el cual incluyó información de expedientes clínicos de pacientes (madres y neonatos) que recibieron atención durante el 01-enero-2019 al 31-diciembre-2019. El estudio fue aprobado por el comité de enseñanza del Hospital Regional ‘General Ignacio Zaragoza’, ISSSTE, previo a la recolección de datos con número de registro 281-2020. Se garantizó la confidencialidad de los datos de los pacientes conforme a los principios éticos establecidos en la Declaración de Helsinki.
Se incluyó información de los expedientes clínicos de recién nacidos y los resultados de los hemocultivos que se realizaron ante sospecha de sepsis neonatal, conforme a las definiciones internacionales del Tercer Consenso Internacional sobre Sepsis y Shock Séptico (Singer et al., 2016). La sepsis fue definida como una disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a una infección.
1.1. Criterios de selección
Se incluyeron en el estudio recién nacidos ingresados en la Unidad de Cuidados Intensivos Neonatales, sin distinción de patología. Se seleccionaron aquellos recién nacidos a quienes se les realizó una toma de hemocultivo con reporte de laboratorio durante su estancia hospitalaria, procedentes de la unidad hospitalaria. Los criterios de exclusión incluyeron a los recién nacidos que no contaban con hemocultivo tomado y aquellos que ingresaron a la unidad antes del periodo establecido para el estudio. Además, se eliminaron del análisis los pacientes que fueron trasladados a otra unidad, impidiendo su seguimiento adecuado, y aquellos cuyos hemocultivos no contaron con un reporte de laboratorio.
1.2. Recolección de la información
La información se obtuvo de los expedientes clínicos electrónicos y físicos de los pacientes incluidos en el estudio. Se registró la edad en días al momento de la toma del hemocultivo. También se identificó el servicio hospitalario donde se realizó la toma, clasificándolo en neonatología para recién nacidos o pediatría para pacientes mayores de 28 días. El crecimiento microbiológico se consideró “positivo” cuando hubo desarrollo de microorganismos en el cultivo tras 48-72 horas de incubación en condiciones controladas y “negativo” en caso contrario. Para determinar el patrón de resistencia antimicrobiana, se realizaron pruebas de sensibilidad mediante el método de difusión con discos (Kirby-Bauer) o sistemas automatizados. Finalmente, la interpretación de la resistencia se categorizó como “sensible,” “intermedio” o “resistente” con base en los puntos de corte establecidos por el CLSI para cada antibiótico evaluado.
1.3. Hemocultivos
Los hemocultivos fueron obtenidos a partir de muestras sanguíneas, las cuales se tomaron por vía periférica y central por parte de los médicos residentes. El equipo de microbiología del hospital realizó los hemocultivos a través del método automatizado BACTEC 9050, con siembras en medios Agar Sangre y Agar MacConkey, o resiembras en medios especiales, según el microorganismo a aislar.
1.4. Patrones de resistencia
Se obtuvieron las sensibilidades antimicrobianas mediante la medición de la concentración mínima inhibitoria (CMI) para los siguientes antibióticos: amikacina, ampicilina, ampicilina/sulbactam, aztreonam, bencilpenicilina, cefazolina, cefepime, cefixima, ceftriaxona, cefuroxima, ciprofloxacino, clindamicina, cloranfenicol, colistina, daptomicina, doxiciclina, eritromicina, ertapenem, gentamicina, levofloxacino, linezolid, meropenem, micafungina, minociclina, moxifloxacino, nitrofurantoína, oxacilina, piperacilina, piperacilina/tazobactam, quinupristina/dalfopristina, rifampicina, tetraciclina, ticarcilina/ácido clavulánico, tigeciclina, tobramicina, trimetoprima, trimetoprima/sulfametoxazol y vancomicina. Esta lista corresponde a los paneles de sensibilidad utilizados por el laboratorio del hospital, diseñados para evaluar el perfil de resistencia de las bacterias aisladas. No todos estos antibióticos son de uso clínico en recién nacidos; la elección terapéutica depende de la edad del paciente, el tipo de infección y las guías clínicas locales. Las bacterias se consideraron productoras de beta-lactamasa de espectro extendido (BLEE) cuando mostraban resistencia a penicilinas, cefalosporinas y carbapenémicos. En el caso de crecimiento fúngico, se realizaron estudios de resistencia para anfotericina B, caspofungina, flucitosina, fluconazol y voriconazol.
1.5. Prueba de resistencia inducida por clindamicina
Para detectar la resistencia inducida por clindamicina, se realizó una prueba conocida como “D-test” (prueba en forma de D). En esta prueba, se colocan discos impregnados con eritromicina y clindamicina en una placa de agar que ha sido previamente sembrada con la bacteria en cuestión. Si las bacterias son resistentes a la eritromicina, pero inicialmente sensibles a la clindamicina, puede formarse una zona de inhibición elíptica alrededor del disco de eritromicina. Luego, se coloca un segundo disco de clindamicina a cierta distancia del disco de eritromicina. Si las bacterias desarrollan resistencia inducida a la clindamicina, se observará una “reducción” en la zona de inhibición alrededor del disco de clindamicina, que se asemejará a una forma de “D”.
1.6. Cálculo de muestra
La tasa de positividad reportada en otros estudios en los hemocultivos de neonatos con sospecha de sepsis neonatal es del 30% (Gudayu et al., 2019). Se utilizó una fórmula de proporciones para calcular la potencia alcanzada con una muestra de 776 hemocultivos, un error alfa del 5%, y dos colas. Si consideramos un aumento en la proporción del 10% de la tasa de positividad de los hemocultivos entre estaciones del año entonces obtuvimos una potencia del 88.7%.
1.7. Análisis estadístico
El análisis estadístico se realizó utilizando el programa SPSS Statistics v26. Para describir las variables cuantitativas, evaluamos previamente la normalidad de la distribución utilizando la prueba de Kolmogorov-Smirnov. Dado que las variables no siguieron una distribución normal, se reportaron como mediana y rango. Las variables categóricas se describieron con frecuencias absolutas (n) y relativas (%).
Para comparar la proporción de hemocultivos positivos entre los meses del año, se utilizó una prueba chi-cuadrado de Pearson. Posteriormente, se aplicó un ajuste post hoc de Bonferroni para identificar diferencias significativas entre pares de meses, controlando el error tipo I asociado a múltiples comparaciones. Las proporciones de positividad de hemocultivos se representaron por mes y por estación del año mediante gráficas de barras apiladas. No se permitieron valores perdidos en los resultados de hemocultivos. Todas las pruebas estadísticas realizadas fueron bivariadas, y se consideró un valor de p < 0.05 como significativo.
2. Resultados
Se incluyeron un total de 776 hemocultivos, que corresponden tanto a muestras iniciales como a resiembras, obtenidos de 211 neonatos con sospecha de sepsis neonatal en nuestro estudio. El 97.3 % de los hemocultivos (n=775) fueron tomados de pacientes que tenían menos de 1 mes de edad, y todos los hemocultivos se realizaron en el servicio de neonatología (776, 100%) (Tabla 1).
Tabla 1
Distribución de la edad al momento de la obtención del hemocultivo y servicio donde se realizó la toma
|
|
|
n |
% |
|
Edad al momento de obtención del hemocultivo |
<1 mes |
755 |
97.3% |
|
|
>1 mes |
٢١ |
٢.٧٪ |
|
Servicio donde se realizó la toma del hemocultivo |
Neonatología |
776 |
١٠٠٪ |
Nota. Distribución de la edad de los neonatos al momento de la obtención del hemocultivo y el servicio donde se realizó la toma.
Trescientos (38.7%) hemocultivos no tuvieron crecimiento microbiano, mientras que la tasa de positividad general fue de 61.3% (n=476). Los microorganismos más comúnmente implicados fueron los cocos gram positivos: Staphylococcus epidermidis (251, 52.73%), Staphylococcus aureus (37, 7.77%) y Staphylococcus hominis (91, 19.12%) (Tabla 2).
Otras bacterias que se aislaron con menos frecuencia fueron Escherichia coli, Enterobacter cloacae y Klebsiella pneumoniae, entre otras (Tabla 2). Veinticuatro (5.04%) hemocultivos tuvieron crecimiento de hongos de los cuales el género Candida fue el único positivo y la distribución fue: Candida albicans (6, 1.26%), Candida krusei (6, 1.26%), Candida parapsilosis (12, 2.52%).
Los microorganismos eran sensibles a antibióticos en su mayoría (272, 57.14%); sin embargo, otros presentaron resistencia intermedia (11, 2.31%) y total (148, 31.09%) (Tabla 2). La prevalencia de bacterias productoras de beta-lactamasas de amplio espectro fue baja (1, 0.21%), así como la positividad a la prueba de cefotaxima (19, 3.99%) y de resistencia inducida por clindamicina (0, 0%).
Tabla 2
Crecimiento microbiano en hemocultivos e interpretación de la sensibilidad antibiótica.
|
|
|
n |
% respecto a hemocultivos positivos (n = 476) |
|
Resultados de hemocultivos |
Brucella melitensis |
1 |
0.21% |
|
|
Candida albicans |
6 |
1.26% |
|
|
Candida krusei |
6 |
1.26% |
|
|
Candida parapsilosis |
12 |
2.52% |
|
|
Enterobacter cloacae |
14 |
2.94% |
|
|
Escherichia coli |
19 |
3.99% |
|
|
Klebsiella pneumoniae |
17 |
3.57% |
|
|
Pseudomonas aeruginosa |
8 |
1.68% |
|
|
Serratia marcescens |
13 |
2.73% |
|
|
Staphylococcus aureus |
37 |
7.77% |
|
|
Staphylococcus epidermidis |
251 |
52.73% |
|
|
Staphylococcus hominis |
91 |
19.12% |
|
|
Stenotrophomonas maltophilia |
1 |
0.21% |
|
Sensibilidad a antibióticos |
Sensible |
272 |
57.14% |
|
|
Intermedio |
11 |
2.31% |
|
|
Resistente |
148 |
31.09% |
Nota. Crecimiento microbiano en hemocultivos y la interpretación de los patrones de sensibilidad antibiótica. Se incluye la distribución de las especies bacterianas y fúngicas identificadas, donde Staphylococcus epidermidis fue el microorganismo más comúnmente aislado, seguido de Staphylococcus hominis y Staphylococcus aureus. La clasificación de la sensibilidad se realizó de acuerdo con los puntos de corte establecidos en el hospital, los cuales se basan en la concentración mínima inhibitoria (CMI) de cada antibiótico. Los aislamientos fueron categorizados como sensibles (si la concentración del antibiótico inhibe efectivamente el crecimiento bacteriano), resistencia intermedia (cuando la inhibición depende de la dosis del fármaco), y resistentes (cuando no se observa inhibición del crecimiento bacteriano dentro de los niveles terapéuticos de ese antibiótico específico).
La tabla del suplemento muestra el patrón de resistencia de los microorganismos (Suplemento 1). Las resistencias de la bacteria Staphylococcus epidermidis fueron las siguientes: bencilpenicilina, ciprofloxacino, clindamicina, eritromicina, gentamicina, moxifloxacino, oxacilina, tetraciclina y trimetoprima/sulfametoxazol (0.4%-6.2%). La bacteria Staphylococcus aureus presentó resistencia a ciprofloxacino, clindamicina, eritromicina, levofloxacino y moxifloxacino (3.1%-6.3%). Los Staphylococcus hominis fueron resistentes a ciprofloxacino, clindamicina, eritromicina, gentamicina, levofloxacino y moxifloxacino (1.3-6.3%). En el caso de los hongos, los patrones de resistencia fueron los siguientes: Candida albicans (sensible a todos los antifúngicos), Candida krusei (resistente a flucitosina y fluconazol) y Candida parapsilosis (sensible a todos los antifúngicos) (8.3%-16.7%).
La mayoría de los hemocultivos positivos se registraron en julio y se encontró que la proporción de positividad varía de acuerdo con el mes de obtención del hemocultivo (p<0.0001) (Figura 1). La proporción de positividad en junio (5.5%), julio (8.9%), agosto (7%) y septiembre (7%) fueron superiores respecto a los meses de febrero (1.9%), abril (1.8%) y mayo (2.3%) (Figura 1). También la tasa de positividad en verano (20.5%), otoño (16.4%) e invierno (16.1%) fue mayor respecto a la proporción de positividad durante los meses que conforman la primavera (8.4%) (p<0.01 para todos) (Figura 2).
Figura 1
Proporción de hemocultivos positivos según el mes de obtención de la muestra
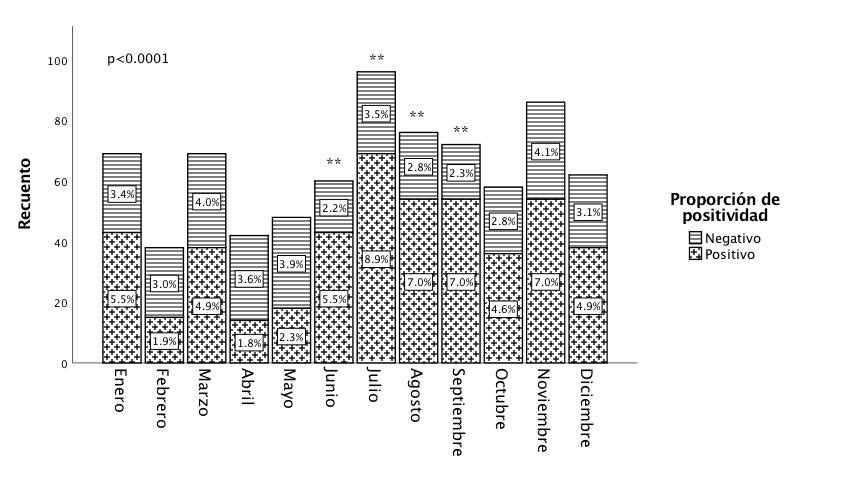
Nota. Proporción de hemocultivos positivos de acuerdo con el mes de obtención de la muestra. Esta gráfica de barras apilada muestra el cambio en la tasa de positividad de los hemocultivos por mes, destacando una mayor proporción de hemocultivos positivos en los meses de verano, con diferencias significativas en comparación con otros meses (χ² = 50.198, gl = 11, p < 0.0001). Para evaluar las diferencias específicas entre meses, se aplicó un ajuste post hoc de Bonferroni. El análisis reveló que la proporción de hemocultivos positivos fue significativamente diferente entre meses específicos (p < 0.0001). De manera similar, se observaron diferencias significativas en los meses de junio, julio, agosto y septiembre en comparación con abril y mayo (p < 0.01). Este ajuste permitió controlar el error tipo I derivado de múltiples comparaciones y confirmó la variabilidad estacional en las tasas de positividad de los hemocultivos. ** p < 0.01.
Figura 2
Proporción de hemocultivos positivos según la estación del año de obtención de la muestra.
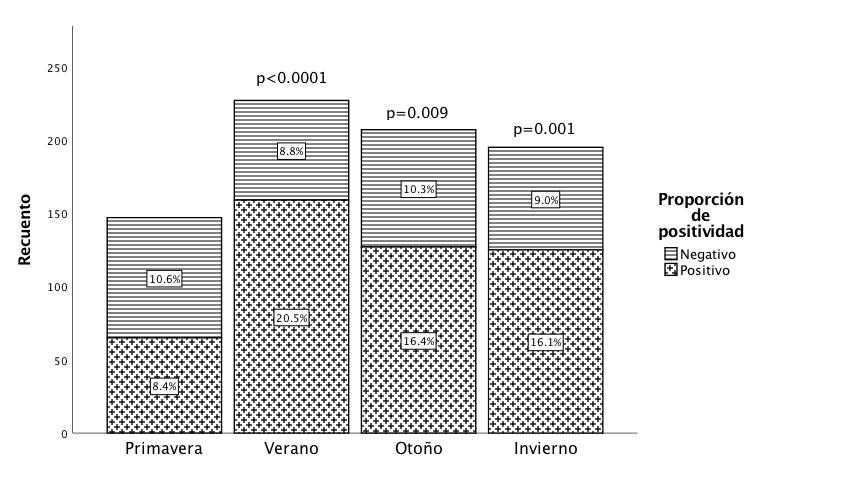
Nota. Proporción de hemocultivos positivos según la estación del año en que se obtuvo la muestra. La gráfica de barras apilada ilustra las tasas de positividad de los hemocultivos en cada estación, destacando un aumento significativo en verano, otoño e invierno en comparación con la primavera (p<0.01). Los valores reportados de p corresponden a los resultados de la prueba de Bonferroni, que comparó la proporción de positividad entre verano, otoño e invierno respecto a la primavera.
3. Discusión
En nuestro estudio la proporción de neonatos con sospecha de sepsis neonatal que tuvieron un hemocultivo positivo fue de 61.3%. En contraste, un estudio en una unidad de cuidados intensivos neonatales de atención privada en México reportó una frecuencia de hemocultivos positivos del 4.3%, con una mayor probabilidad de aislamientos en sepsis tardía (30.6%) en comparación con sepsis temprana (1.8%) (Marín-Romero et al., 2015). Los microorganismos más frecuentemente aislados en nuestro estudio fueron cocos gram positivos como Staphylococcus epidermidis (251, 52.73%), Staphylococcus aureus (37, 7.77%) y Staphylococcus hominis (91, 19.12%), mientras que en la UCIN privada los aislamientos más frecuentes fueron también Staphylococcus epidermidis, Staphylococcus haemolyticus y Streptococcus agalactiae en sepsis temprana y Staphylococcus epidermidis, Klebsiella pneumoniae y Enterobacter aerogenes en sepsis tardía (Marín-Romero et al., 2015).
Cerca de un tercio de los crecimientos bacterianos presentaban resistencia a uno o más antibióticos (31.09%). Las resistencias a antibióticos de las bacterias más comunes (Staphylococcus) de acuerdo con un antibiótico específico variaron de 0.4%-6.2%, mientras que las resistencias de los hongos a los antifúngicos fueron de 8.3%-16.7%. La presencia mayoritaria de cocos gram positivos podría relacionarse con diversos factores, incluidos los protocolos de higiene hospitalarios, la elevada frecuencia de dispositivos intravasculares en las unidades de cuidados intensivos, así como el uso empírico de antibióticos que tradicionalmente se ha dirigido de manera más agresiva contra bacilos gram negativos. Aunque no contamos con datos específicos de nuestro hospital acerca de los esquemas antibióticos o las medidas de control de infecciones, la evidencia sugiere que los cocos gram positivos, en especial los estafilococos coagulasa negativos, pueden adquirir relevancia cuando hay brechas en la asepsia o cuando existe un mayor empleo de catéteres venosos centrales y procedimientos invasivos (Procianoy y Silveira, 2020).
Los resultados de nuestro estudio reflejan la complejidad en el manejo de la sepsis neonatal, que sigue siendo un desafío tanto a nivel diagnóstico como terapéutico. La literatura reciente destaca la necesidad de una aproximación más cuidadosa al diagnóstico y tratamiento de la sepsis neonatal. Procianoy y Silveira (2020) subrayan la importancia de identificar los factores de riesgo y agentes etiológicos específicos para poder implementar un enfoque más dirigido en el manejo de la sepsis, enfatizando que los métodos tradicionales como el uso empírico de antibióticos, especialmente vancomicina, no deben ser aplicados de manera rutinaria en todos los casos. Por otro lado, Celik et al. (2022) describen los avances en las técnicas diagnósticas no basadas en cultivos, como los métodos moleculares y la espectrometría de masas, los cuales ofrecen la posibilidad de superar las limitaciones de los métodos convencionales al proporcionar diagnósticos más rápidos y precisos, lo que podría reducir el uso innecesario de antibióticos y mejorar los desenlaces clínicos. Estos hallazgos refuerzan la necesidad de implementar nuevas estrategias diagnósticas y terapéuticas que puedan aplicarse en un contexto hospitalario como el nuestro, donde la sepsis neonatal sigue siendo un problema relevante.
Llama la atención el predominio de cocos gram positivos (particularmente Staphylococcus epidermidis, Staphylococcus aureus y Staphylococcus hominis), en contraste con otros trabajos realizados en México, donde se han reportado tasas elevadas de bacilos gram negativos como Escherichia coli y Klebsiella pneumoniae (Patel, S. J et al., 2010; Pérez et al., 2015). De manera similar, en un hospital de tercer nivel en la Ciudad de México, Klebsiella pneumoniae fue el patógeno más frecuente en sepsis neonatal, con una alta mortalidad del 79% en los pacientes infectados (Rodríguez-Weber et al., 2003). Además, en una UCIN privada, la sepsis temprana estuvo principalmente causada por Staphylococcus epidermidis y otros cocos gram positivos, mientras que en sepsis tardía predominaron Klebsiella pneumoniae y Enterobacter aerogenes (Marín-Romero et al., 2015). Otro estudio del Estado de México reportó que los microorganismos más comunes en 378 casos de sepsis neonatal fueron Escherichia coli (22.22%), Klebsiella pneumoniae (19.84%) y Staphylococcus epidermidis (19.3%) (Ostia-Garza et al., 2021). Otro estudio que incluyó a 14,207 pacientes con sepsis neonatal reportó que el 72% de las bacterias aisladas eran bacilos gram negativos (Pérez et al., 2015) De manera similar, en un estudio internacional en países de ingresos bajos y medios, se observó que la sepsis neonatal sigue siendo una causa importante de mortalidad neonatal, con una incidencia de sepsis confirmada por laboratorio de 46.9 por cada 1,000 nacidos vivos y tasas de mortalidad de 0.83 por cada 1,000 días-neonato (Milton et al., 2022). Las bacterias gram negativas prevalecen en estos países, al igual que en México. Sin embargo, la falta de herramientas diagnósticas precisas en países de ingresos bajos y medios contribuye a la subestimación de la incidencia real de la sepsis neonatal (Popescu et al., 2020). Otro estudio que incluyó 122 casos de sepsis neonatal ingresados en la Unidad de Cuidados Intensivos Neonatales del Hospital Juárez de México reportó que el Staphylococcus coagulasa negativo (32%) fue el microorganismo aislado más frecuente en sepsis neonatal tardía, y Escherichia coli (9.8%) y Klebsiella pneumoniae (7.3%) fueron los más frecuentes en sepsis neonatal temprana (Ulloa-Ricárdez et al., 2019). En contraste, nuestro estudio reporta que la mayoría de los casos de sepsis neonatal son causados por cocos gram positivos. Por lo tanto, resulta fundamental reforzar las prácticas de vigilancia epidemiológica y control de infecciones para reducir la carga de sepsis neonatal por este tipo de microorganismos. En este sentido, estudios en hospitales públicos y privados de México han demostrado que la etiología de la sepsis neonatal varía según el nivel de atención, siendo los bacilos gram negativos predominantes en hospitales públicos y los cocos gram positivos más frecuentes en hospitales privados (Rodríguez-Weber et al., 2003; Marín-Romero et al., 2015). Esto refuerza la importancia de adaptar las estrategias de prevención y tratamiento antimicrobiano a la epidemiología local de cada hospital.
Existen múltiples estudios que han analizado a pacientes con sepsis neonatal con hemocultivo negativo. La relación que existe entre sepsis neonatal confirmada por hemocultivo y sepsis neonatal con hemocultivo negativo varía de 1:6 a 1:16 según múltiples estudios. Por ejemplo, un estudio en Noruega reportó una relación 1:16 (Fjalstad et al., 2016); otro estudio que incluyó a pacientes originarios de Dinamarca reportó una relación 1:6 (Drageset et al., 2017); dos estudios realizados en Austria y Canadá reportaron una relación de 1:7 (Hofer et al., 2012; Lacaze-Masmonteil et al., 2014) y un estudio de Suiza reportó una relación 1:12 (Duvoisin et al., 2020) a favor de la sepsis neonatal con hemocultivos negativos. En nuestro estudio, la tasa de positividad de los hemocultivos varió según el mes y estación del año. En nuestro estudio reportamos tasas de positividad superiores entre los meses de junio a septiembre, y mayor tasa de positividad durante verano, otoño e invierno (16.1%-20.5%) respecto a primavera (8.4%). En un hospital de tercer nivel en la Ciudad de México, se observó que la mortalidad por sepsis neonatal era mayor en neonatos con Klebsiella pneumoniae, con una alta frecuencia de casos en los primeros días de vida, lo que refuerza la importancia de identificar patrones epidemiológicos locales para la optimización del manejo antimicrobiano (Rodríguez-Weber et al., 2003).
En relación con la variabilidad estacional, identificamos una mayor tasa de positividad de hemocultivos en verano, otoño e invierno, en comparación con la primavera. Esta observación coincide con hallazgos previos que sugieren un comportamiento estacional de la sepsis neonatal (Gudayu et al., 2019). De igual forma, estudios internacionales han documentado incrementos significativos en la incidencia de sepsis durante los meses cálidos o en ciertas estaciones del año (Shah et al., 2011) describieron un aumento notable de infecciones gram negativas durante los meses de verano en Canadá, mientras que Omoregie (Omoregie et al., 2009) reportaron mayor proporción de sepsis en la época seca de Nigeria, especialmente en mujeres. Un informe más reciente desde Egipto encontró diferencias sustanciales en la distribución de patógenos entre verano e invierno, con mayor predominio de Klebsiella y Enterobacter en los meses de verano (Abdel et al., 2021). Aunque nuestro estudio no profundizó en los posibles factores que subyacen a esta variación, se han propuesto hipótesis como el aumento de la temperatura y humedad, que podrían favorecer la proliferación de microorganismos en la unidad hospitalaria (Gudayu et al. 2019; Shah et al., 2011; Omoregie et al., 2009). Asimismo, es posible que factores organizacionales, como la rotación de personal de salud en ciertas temporadas, o incluso la variación en la dotación de insumos y recursos, influyan en los picos estacionales de sepsis.
3.1. Limitaciones
El estudio tiene algunas limitaciones que vale la pena mencionar. Primero, es un estudio retrospectivo, lo cual lleva a posibles sesgos de información. Por ejemplo, no se recabaron las edades de los pacientes, lo cual limitó el análisis de asociación entre la edad y la positividad de los hemocultivos. Además, no se incluyeron variables relevantes como marcadores hematológicos de inflamación (ej., PCR), diagnósticos moleculares microbiológicos ni desenlaces clínicos o variables de tratamiento. Tampoco se investigaron microorganismos que no crecen en hemocultivos, como los virus. Cantey y Lee (2021) destacan que los biomarcadores actualmente disponibles no tienen la sensibilidad ni especificidad adecuada para diagnosticar la sepsis neonatal, lo cual añade una limitación diagnóstica importante en nuestro estudio. Asimismo, el ensayo clínico realizado por Roca et al. (2023) sugiere que intervenciones adicionales como la administración de azitromicina durante el parto no lograron reducir la mortalidad ni la incidencia de sepsis neonatal, lo que subraya la necesidad de explorar otras estrategias terapéuticas más efectivas. También, a pesar de que el tamaño de muestra es mediano a grande, puede ser que la potencia esté limitada en el análisis de bacterias u hongos poco prevalentes. Por lo tanto, incluir un tamaño de muestra mayor podría ser útil en estudios futuros. A pesar de estas limitaciones, el estudio ofrece una descripción local de las principales etiologías microbiológicas, y sus patrones de resistencia en neonatos con diagnóstico de sepsis neonatal. Además, se realizó un análisis temporal que incluyó a los neonatos atendidos durante un año continuo en nuestro hospital. Estos hallazgos permiten optimizar los tratamientos empíricos y reducir la morbilidad y la mortalidad en neonatos con sepsis neonatal.
3.2. Alcances y perspectivas
Este estudio provee información epidemiológica relevante sobre la positividad de hemocultivos, los patrones de resistencia antimicrobiana y las bacterias predominantes en un hospital de segundo nivel de atención en México. Si bien los resultados reflejan la realidad de este nosocomio específico, podrían servir como base para realizar comparaciones con otros hospitales de características similares o como punto de partida para estudios multicéntricos que aborden esta problemática a nivel nacional.
4. Conclusiones
En conclusión, nuestro estudio describe de forma integral la epidemiología local de la sepsis neonatal en un hospital de segundo nivel, evidenciando que los cocos gram positivos constituyen los principales agentes etiológicos y que cerca de un tercio de los aislamientos presentan resistencia a uno o más antibióticos. Estos hallazgos realzan la necesidad de diseñar protocolos de manejo empírico que contemplen, de manera temprana, la cobertura contra estafilococos. Asimismo, las variaciones estacionales identificadas, con tasas de positividad superiores en verano, otoño e invierno, sugieren la existencia de factores climatológicos u organizacionales que pueden incidir en la dinámica de la sepsis neonatal y requieren mayor atención.
La elevada tasa de positividad de los hemocultivos señala la importancia de fortalecer las medidas de control de infecciones y de vigilancia epidemiológica, así como de optimizar la oportunidad y precisión del diagnóstico microbiológico. En este sentido, resulta urgente implementar estrategias que mejoren la detección temprana de los casos, fomenten un uso racional de los antibióticos y, en última instancia, reduzcan la morbilidad y mortalidad neonatal asociadas a sepsis.
Declaratoria de conflicto de interés
Los autores declaran no tener ningún conflicto de interés
Declaratoria de disponibilidad de datos
Los datos recabados y utilizados en el estudio no son públicos y no se encuentran en ningún repertorio digital.
Referencias
Cantey, J. B., & Lee, J. H. (2021). Biomarkers for the diagnosis of neonatal sepsis. Clinics in Perinatology, 48(2), 215-227. https://doi.org/10.1016/j.clp.2021.03.012
Celik, I. H., Hanna, M., Canpolat, F. E., & Pammi, M. (2022). Diagnosis of neonatal sepsis: The past, present and future. Pediatric Research, 91(2), 337-350. https://doi.org/10.1038/s41390-021-01696-z
Duvoisin, G., Fischer, C., Maucort-Boulch, D., & Giannoni, E. (2014). Reduction in the use of diagnostic tests in infants with risk factors for early-onset neonatal sepsis does not delay antibiotic treatment. Swiss Medical Weekly, 144, 13981.
Drageset, M., Fjalstad, J. W., Mortensen, S., & Klingenberg, C. (2017). Management of early-onset neonatal sepsis differs in the north and south of Scandinavia. Acta Paediatrica, 106(3), 375-381.
Fleiss, N., Schwabenbauer, K., Randis, T. M., & Polin, R. A. (2023). What’s new in the management of neonatal early-onset sepsis? Archives of Disease in Childhood-Fetal and Neonatal Edition, 108(1), 10-14.
Fjalstad, J. W., Stensvold, H. J., Bergseng, H., Simonsen, G. S., Salvesen, B., Rønnestad, A. E., & Klingenberg, C. (2016). Early-onset sepsis and antibiotic exposure in term infants: A nationwide population-based study in Norway. The Pediatric Infectious Disease Journal, 35(1), 1-6.
Gudayu, T. W., Zeleke, E. G., & Lakew, A. M. (2019). The role of the season at admission in neonatal sepsis: A retrospective chart review of a 1-year data at University of Gondar comprehensive specialized hospital. BMC Research Notes, 12, 1-6.
Hofer, N., Müller, W., & Resch, B. (2012). Neonates presenting with temperature symptoms: Role in the diagnosis of early onset sepsis. Pediatrics International, 54(4), 486-490.
Klingenberg, C., Kornelisse, R. F., Buonocore, G., Maier, R. F., & Stocker, M. (2018). Culture-negative early-onset neonatal sepsis—at the crossroad between efficient sepsis care and antimicrobial stewardship. Frontiers in Pediatrics, 6, 285.
Lacaze-Masmonteil, T., Rosychuk, R. J., & Robinson, J. L. (2014). Value of a single C-reactive protein measurement at 18 h of age. Archives of Disease in Childhood-Fetal and Neonatal Edition, 99(1), F76-F79.
Lozano-Ascencio, R., & Santos-Preciado, J. I. (2005). Mortalidad en menores de cinco años mexicanos en 2004: Hacia los objetivos del milenio. Boletín Médico del Hospital Infantil de México, 62(6), 406-420.
Marín-Romero, M., Iglesias-Leboreiro, J., Bernárdez-Zapata, I., & Rendón-Macías, M. E. (2015). Características de la sepsis neonatal en una Unidad de Cuidados Intensivos Neonatales de atención privada. Revista Mexicana de Pediatría, 82(3), 93-97.
Milton, R., Gillespie, D., Dyer, C., Taiyari, K., Carvalho, M. J., Thomson, K., ... & Chan, G. J. (2022). Neonatal sepsis and mortality in low-income and middle-income countries from a facility-based birth cohort: An international multisite prospective observational study. The Lancet Global Health, 10(5), e661-e672.
Mostafa, E. A., Hasanin, R. M., & Salah, M. M. (2021). Assessment of seasonal variation on neonatal sepsis. Bulletin of the National Research Centre, 45(1), 1-9.
Omoregie, R., Egbe, C. A., Ogefere, H. O., Igbarumah, I., & Omijie, R. E. (2009). Effects of gender and seasonal variation on the prevalence of bacterial septicaemia among young children in Benin City, Nigeria. Libyan Journal of Medicine, 4(3), 1-8.
Ostia-Garza, P. J., & Salzar-Espino, B. (2021). Frecuencia de factores relacionados con sepsis neonatal. Perinatología y Reproducción Humana, 35(1), 3-9.
Patel, S. J., & Saiman, L. (2010). Antibiotic resistance in neonatal intensive care unit pathogens: Mechanisms, clinical impact, and prevention including antibiotic stewardship. Clinics in Perinatology, 37(3), 547-563.
Pérez, R. O., Lona, J. C., Quiles, M., Verdugo, M. Á., Ascencio, E. P., & Benítez, E. A. (2015). Sepsis neonatal temprana, incidencia y factores de riesgo asociados en un hospital público del occidente de México. Revista Chilena de Infectología, 32(4), 447-452.
Procianoy, R. S., & Silveira, R. C. (2020). The challenges of neonatal sepsis management. Jornal de Pediatria, 96(Suppl 1), 80-86.
Popescu, C. R., Cavanagh, M. M., Tembo, B., Chiume, M., Lufesi, N., Goldfarb, D. M., ... & Lavoie, P. M. (2020). Neonatal sepsis in low-income countries: Epidemiology, diagnosis and prevention. Expert Review of Anti-infective Therapy, 18(5), 443-452.
Roca, A., Camara, B., Bognini, J. D., Nakakana, U. N., Somé, A. M., Beloum, N., ... & PregnAnZI-2 Working Group. (2023). Effect of intrapartum azithromycin vs placebo on neonatal sepsis and death: A randomized clinical trial. JAMA, 329(9), 716-724.
Rodríguez-Weber, M. A., López-Candiani, C., Arredondo-García, J. L., Gutiérrez-Castrellón, P., & Sánchez-Arriaga, F. (2003). Morbilidad y mortalidad por sepsis neonatal en un hospital de tercer nivel de atención. Salud Pública de México, 45, 90-95.
Sands, K., Spiller, O. B., Thomson, K., Portal, E. A., Iregbu, K. C., & Walsh, T. R. (2022). Early-onset neonatal sepsis in low-and middle-income countries: Current challenges and future opportunities. Infection and Drug Resistance, 15, 933-946.
Seale, A. C., Blencowe, H., Manu, A. A., Nair, H., Bahl, R., Qazi, S. A., ... & Lawn, J. E. (2014). Estimates of possible severe bacterial infection in neonates in sub-Saharan Africa, South Asia, and Latin America for 2012: A systematic review and meta-analysis. The Lancet Infectious Diseases, 14(8), 731-741.
Shane, A. L., & Stoll, B. J. (2013). Recent developments and current issues in the epidemiology, diagnosis, and management of bacterial and fungal neonatal sepsis. American Journal of Perinatology, 30(2), 131-142.
Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., ... & Angus, D. C. (2016). The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA, 315(8), 801-810.
Tsafaras, G. P., Ntontsi, P., & Xanthou, G. (2020). Advantages and limitations of the neonatal immune system. Frontiers in Pediatrics, 8, 5.
Ulloa-Ricárdez, A., & Salazar-Espino, B. (2019). Epidemiología de infección neonatal temprana y tardía en una Unidad de Cuidados Intensivos Neonatales. Revista del Hospital Juárez de México, 86(3), 110-115.
Shah, P. S., Yoon, W., Kalapesi, Z., Bassil, K., Dunn, M., & Lee, S. K. (2013). Seasonal variations in healthcare-associated infection in neonates in Canada. Archives of Disease in Childhood-Fetal and Neonatal Edition, 98(1), F65-F69.