Las implicaciones de la hipe rmutación somática,
en la gene ración de la diversidad en la respuesta inmunulógica
José
A
García
Coordinación General de lnvestigación, Universidad La Salle
<jgarc1a@c1.ulsa.mx>
RESUMEN
Se presenta un breve análisis de las implicaciones del fenómeno de hipermutación somática en los receptores linfoides inmunocompetentes. Se destaca la
implicación de dicho fenómeno en el receptor de células T (TCR).
Palabras
clave: hipermutación
somática, receptores linfoides inmunocompetentes.
ABSTRACT
A brief analysis of lhe implications of somatic hypermutation phenomena in the lymphoid immunocompe tent receptors is presented. The implication of
this event in the T-cell receptor (TCR) is emphasized .
Keywords.
somatic
hypermut
alíon,
l
ymphoid immunocompetent
receptors.
INTRODUCCIÓN
Una de las propiedades más importantes de la respuesta inmune consiste en la gran diversi dad de molécula que pueden ser reconocidas por sus
receptores, especialmente por el anti cuerpo. Se puede considerar un repertorio potencial de 109 clonas de linfocitos B específi cos que son
generados en la médula ósea de los vertebrados adultos.
La generación de la diversidad se produce mediante dos mecanismos. El primero ocurre en el proceso de diferenciación de las células B y está dado por
el rearreglo de los genes varia bles (V), de diversidad (O) y de unión (J) de la cadena pesada del anticuerpo, asicorno de los genes V y J de la
cadena ligera (1). En este pro ceso se genera la mayor parte del repertorio de células B. El segundo es por la hipermutación somática .
Durante la ontogenia del linfocito B, las célu
las inmaduras al encontrarse con su antígeno
son eliminadas por apoptosis. lo que disminuye el número de células potencialmente autorreac tivas (2). Aquéllas que superan este proceso salen a
circulación para recorrer los diferentes órganos linfáticos en busca de su antígeno.
Cuando el receptor de células B (BCR) se encuentra con su antígeno, ocurre el proceso de activación y diferenciación a células plas máticas. Si este
proceso se lleva a cabo en los centros germinales y además interviene de manera directa el linfocito T, entonces ocurre el proceso de hipermutación
somática. con lo que se aumenta el repertorio original (3). Dada la presencia del antígeno en estas zonas, se favorece la proliferación de las clonas
con
mayor afinidad, por lo que la h1permutación somática está asociada a un proceso de madu ración de la afinidad (4).
La participación del linfocito T CD4+ en la hipermutación somática es dosis dependiente y
a través de moléculas de adhesión específicas
Rev
C
entro
lrw
(Méx)
Vol 4 Num 1 Agosto 2000 89
 como el ligando de C040 y el CD28 que interac túan en la célula B con CD40 y B7 respectiva mente (5). El proceso parece activarse en el estadio del
centroblasto para que posterior mente las células dendríticas foliculares (FDCs) seleccionen a las células B en el estadio del centroc1to (6).
como el ligando de C040 y el CD28 que interac túan en la célula B con CD40 y B7 respectiva mente (5). El proceso parece activarse en el estadio del
centroblasto para que posterior mente las células dendríticas foliculares (FDCs) seleccionen a las células B en el estadio del centroc1to (6).
LOS CENTROS GERMINALES (GCs)
En la pulpa blanca del bazo se pueden distinguir 3 regiones: la zona marginal (MZ); la cubierta linfoide periarteriolar (PALS); y el folículo. La
primera representa el sitio de entrada de los lin focitos de la circulación al bazo y es también hogar de macrófagos especializados y una sub
poblac1ón de linfocitos B lgMhilgDlo. En la PA LS encontramos ei área de células T. que además es rica en células dendr íticas interdigitantes , un
tipo de célula presentadora de antígeno (APC). El folículo es el área de células B de la pulpa blanca que contiene además FDCs que actúan "atrapando"
de manera eficiente al antígeno (7).
Los linfocitos B y T que se encuentran en cir· culación entran a la MZ para luego ingresar a la PALS donde los linfocitos T permanecen, las células B
continúan hacia el folículo. En ausen cia de estirnulación antigénica ambos linfocitos regresan a circulación probablemente a través del seno marginal
(7).
En la presencia de antígeno el panorama anterior cambia de manera radical. El antígeno se localiza inicialmente asociado a las células dendríticas
interdigitantes quienes presentan éste a las células T específicas, deteniendo su migración e induciéndolas a proliferar (8). Los linfocitos B
estimulados por el antígeno, migran hacia la PALS donde reciben la cooperación de células T y proliferan en consecuencia. La mayoría de los linfocitos
B sufre un proceso de diferenciación a células plasmáticas produc toras de anticuerpos de la clase lgM en princi pio, pero posteriormente pueden
hacer el switch a otro isotipo (lgG, lgE, lgA). Estas células tienen un tiempo de vida media relativamente corto y mueren por apoptosis en aproximada
mente 2 semanas tras el estimulo antigénico original. Algunas células B y T específicas migran hacia folículos adyacentes. donde el antígeno se
encuentra asociado a la membrana de las FDCs (9). Las células B que migran hacia
9
0
los folículos prolíferan localmente para formar GCs. Dentro de las moléculas que intervienen en el fenómeno se encuentran los factores de transcripción
OCA-B/Bob-1/0BF-1 (1O) y SPl-B (11): los receptores para el complemento 1 y 2 (CD21/CD35) (12); así corno la expresión de 1as proteínas BCL--6 (13) y
OX40 (14) .
El GC contiene inicialmente sólo centroblas tos en división y posteriormente presenta las caracteristicas zonas obscuras y luminosas que contienen a
los centroblastos y a los centrocitos (que no se dividen) respectivamente. La zona luminosa es la región del GC rica en la red de FDCs donde gran parte
de los complejos inmunes son "atrapados". Se piensa que la hipermutación somática de los genes variables de las inmunoglobulinas ocurre en los centro
blastos lg- que subsecuentemente migran hacia la zona luminosa donde re-expresan la inmunoglobulina de superfic ie (7).
En esta zona, aquéllas clonas con suficiente afinidad por el antígeno sobreviven. mientras que el resto muere por apoptos1s, aunque se ha reportado,
que algunas de estas últimas clonas pueden ser rescatadas por una nueva acti vación de los genes RAG-1 y RAG-2, respon sables de la recombinación de
los genes en la región variable ( 15). Dada la alta concentración de células B en los GCs, se presenta el fenó meno de competencia por el antígeno que
se encuentra en las FDCs, con lo que aquéllas clonas con mayor afinidad se verán favoreci das. Las clonas que fueron seleccionadas posi tivamente,
pueden reingresar a la zona obscura para posterlores eventos de mutación y selec ción, con lo que se va mejorando la afinidad de la respL1esta
Inmunológica (Fig. 1).
CARAC1ERISTICAS DE LA HIPERMUTACIÓN SOMÁTICA EN CÉLULAS B
La hipermutación somática de los genes V(D)J del anticuerpo es activada en las células B que se encuentran en los GCs, donde son introduci das
mutaciones puntuales y, en menor grado. inserciones y deleciones en una región de 1 a 2 kilopares de bases por abajo del sitio de inicio de la
transcripción (16).
La característica más sobresaliente de la hi permutación somática. es precisamente el rango
Rev
C
entro
lnv.
(Méx) Vol 4. Num 15
A
gosto
2000
A
níc11 /o


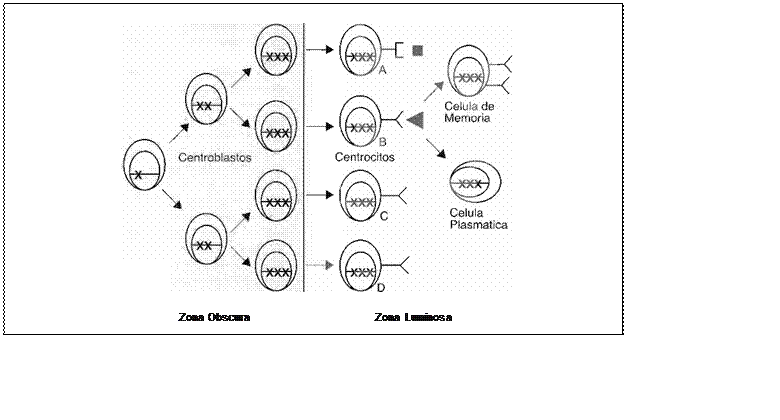
Figura
1
Selección positiva de clonas inmunocompetentes
tras la hipermutacíón somática del anticuer po. A: existe contacto con el aniígeno (vía FDC) pero no hay cooperación de T; con la consecuente apoptosis. B: hay contacto tanto con el antígeno (via FDC) como con el ligando de CD40 (CD40-L) en la superficie del linfocito T; consecuentemente la clona se activa y se generan células de memoria y células
plasmáticas productoras de anticuerpos
.
C y D. no se encuentra el antígeno en el GC o la afinidad del receptor es muy baja; estas clonas se eliminan por apoptosis.
tan alto de mutación que se presenta, y que se estima que puede alcanzar hasta una mutación puntual por cada 1000 bp por generación celu lar, la cual
supera en varios órdenes de magni tud a ta mutación espontánea (3). Casi todas las mutaciones encontradas son por sustitución. con muy pocas
inserciones o deleciones de nucleótidos. Existe evidencia de que sólo una de las cadenas del ONA sufre el proceso, lo que descarta la posibihdad de
atribuir el fenómeno a la acción de la DMA polimerasa (3).
En el proceso de la hipermutación somática. se ha reportado una mayor frecuencia de mutación en ciertas regiones llamadas hot spots, las cuales se
encuentran concentradas en las regiones hipervariables (CDRs) más que en las regiones del armazón (framework). La presencia de hot spots parece estar
dada por los codones de serina AGY (donde Y = ?) en las regiones hípervariables (17).
Rev. Centro lnv (Méx} Vol 4, Núm
.
15 Agosto 2000
HlPERMUTACIÓN SOMÁTICA EN EL RECEP TOR DE CÉLULAS T (TCR)
El fenómeno de la hipermutación somática se ha considerado por años que sólo ocurre en los ge nes variables del anticuerpo. En uno de los pri meros
intentos por tratar de observar este pro ceso en el TCR se transfectaron células B con un transgén del TCR bajo el control del amplifi cador de la
cadena pesada de las inmunoglobu linas (18). En este modelo no se reportaron mutaciones en las regiones variables del TCR,
a pesar de que los anticuerpos sí la llevaron a
cabo.
La hipermutación somática en el TCR se reportó por primera vez en las cadenas alfa de un receptor murino (19). En estos experimentos no se encontró
hipermutación somática en la cadenas beta y tanto la frecuencia como la na turaleza de las sustituciones de las mutaciones
de las cadenas alfa fueron simHarns al caso dél
91

anticuerpo. Este grupo reportó evidencia directa de que una pequeña población de células T antígeno-específicas que son reclutadas de centros
germinales del bazo, adquieren muta ciones en las regiones que codifican para los
genes variables de la cadena a del TCR (Va),
pero no en las cadenas b. Aseveraron que las mutaciones locus-especificas encontradas alcanzan frecuencias comparables con los exones de VH de
inmunoglobulínas mutadas recuperadas del mismo sitio y que presentan una substitución de bases similar y polaridad en las cadenas del DNA. Linfocitos T
que presen tan mutaciones idénticas aparecen en múltiples GCs, lo que posiblemente implique que algunas células que llevan TCRs mutados puedan recir
cular a través delsistema linfático.
Posteriormente se reportaron mutaciones en la cadena beta de otro receptor murino, aunque no se reportaron estos cambios como hiper mutación somática
(20). Cabe notar que el grado de mutación en este caso no fue del mismo grado que el reportado por el grupo de Kelsoe (19), donde la frecuencia de
hipermuta ciones puede deberse al hecho de que las célu las T fueron aisladas de los centros germinales (GC) donde se sabe que ocurre este fenómeno
en el caso del anticuerpo.
Más recientemente se reportó la presencia de hipermutación somática en la cadena beta 3 (Vb3) del TCR en muestras de bazo microdisec cionado de
pacientes seropositivos para el virus de la inmunodeficiencia humana (HIV) (21). En dichas muestras se encontró que tanto la fre cuencia de mutaciones
como de la naturaleza de las sustituciones era similar al caso del anti
cuerpo. Este representa el primer reporte del fenómeno en humanos, ya que articulas anterio res sólo habían estudiado receptores murinos.
IMPLICACIONES DE LA HIPERMUTACIÓN
SOMATICA
La hipermutación somática genera nuevas especificida des en el repertorio de la respuesta inmunológica. Como consecuencia de este fenómeno. pueden
producirse clonas potencial mente autorreactivas. En el caso de las células
B. las clonas autorreactivas son eliminadas dada su susceptibilidad elevada a las señales de apoptosis que no pueden ser revertidas
92
debido tanto a la ausencia de antígeno específi co en la superficie de las FDCs, como de la falta de cooperación con las células T (Figura 1).
En el caso de las células T el mecanismo de hipermutacíón somática ha sido descrito recien temente, por lo que se dificulta su interpre
tación. Es posible que este fenómeno también
genere clonas potencialmente autorreactivas. que en principio tendrían que ser eliminadas vía apoptosis. Sin embargo, permanece la posibili dad de que
se generen clonas autorreactivas de células 8 y T de manera simultánea (es decir, para el mismo antígeno) y que esta especifici dad se encuentre
representada dentro de las moléculas presentadas por las FDCs. En este último caso quedaria latente el desarrollo de una enfermedad autoínmune.
REFERENCIAS
(1) Bernard, O., N. Hozumi, & S. Tonegawa, "Sequences of mouse irnmunoglobulin light chaín genes befare and after somatic changes", Ce//
15, pp. 1133-1144, 1978.
(2) Burnet, F.M., The clona/ setectíon theory of acq uired immuní ty, The University Press, Cambridge, UK., 1959.
(3) Storb, U . "The molecular bas1s of somatic hypermutation of immunoglobulin genes'', Curr. Opín. lmmunol. 8, pp. 206-214, 1996.
(4) Pierre, D.M., et al. "Somalic evolution in the immune system: the need for germinal cen ters for efficient affinity maturation"
, J. theor. Biol. 186, pp.
159-171, 1997.
(5) Han. S., et al.. "Cellular interaction in germi nal centers. Roles of CD40 lígand and B7-2 in established germinal centers", J. lmmunol. pp. 155, 556-567, 1995.
(6) Kelsoe, G. "In situ studies of germinal cen ter reactíon", Adv. lmmunol . 60, pp.
267- 288, 1995.
(7) Tarlinton, D. "Germinal centers: form and function'', Curr. Opin. lmmunol. 1O, pp. 245- 251,
1998.
(8) Kearney, E.R., et al. "Visualization of pep tide-specific T cell imrnunity and peripheral tolera nce índuction in vivo" , lmmunity 1,pp. 327-339, 1994.
(9) Jacobs, J. & G., Kelsoe. "In sítu studies of
ciated foci and germinal centers", J. Exp.
Med.
176,pp. 679-687, 1992.
(10) Kim, U., et af.,"The B cell specific transcrip tion coactivator OCA-8/0BF-1/Bob-1 is essentíal for normal production of immunoglobul in
isotypes'', Nature 383. pp. 542-547, 1996.
(11) Su, G.H., et al ., "Defective 8 cell receptor mediated responses in míce lacking the ETS protein,SPl-8",EMBO J. 16, pp. 7118- 7129.
1997.
(12) Malina, M., et al., "Markedly impaired humoral immune response in mice deficient in complement receptors 1 and 2". Proc. Natl. Acad. Sci. USA 93, pp. 3357-3361, 1996.
(13) Fukuda, T.. et al., "Disruption of the Bcl6 gene results in impaired germinal oenter formation", J. Exp. Med . 186, pp. 439-448 , 1997.
(14) Stüber, E. & W. Strober, "The T cell-8 cell interaction via OX40-0X40L is necessary far the T cell-dependent humoral immune response", J. Exp. Med. 183, pp. 979-989 , 1996.
R<:v
C<;n/fo lnv (Mé"')
Vol
4 Num.
1
5
Agosto 2000
(15)Han, S., et al., "V(D)J recombinase in a subset of germinal center 8 lymphocytes", Science 278, pp. 301-305,1997.
(16) Kelsoe, G., "V(O)J hypermutation and receptor revision: coloring outside the lines•, Curr. Opi n. lmmunol. 11, pp. 70-75, 1999.
(17) Wagner. S., C. Milstein & M. Neuberger. "Codon bias targets mutation", Nature 376, pp. 732, 1995.
(18) Hackett. J.Jr., et al. "Analysis of a T cell receptor gene as a target of !he somatic hypermutalion mechanism". J. Exp. Med.
176, pp. 225-231 , 1992.
(19) Zheng, B., W. Xue & G. Kelsoe, "Locus specific somatic hyperrnutation in germinal center T cells'', Nature 372, pp. 556-559. 1994.
(20)MacHeyzer-Williams. M.G. & M.M. Davis, "Antigen-specific development of primary and memory T cells in vivo", Science 268, pp. 106-111,
1995.
(21)Cheynier, R., S. Henrichwark & S. Wain Hobson, "Somatic hypermulalion of the T cell receptor Vb gene in microdissected splenic white pulps from
HIV-1 positive patients". Eur. J. fmmunof. 28, pp. 1604- 1610, 1998.
![]() como el ligando de C040 y el CD28 que interac túan en la célula B con CD40 y B7 respectiva mente (5). El proceso parece activarse en el estadio del
centroblasto para que posterior mente las células dendríticas foliculares (FDCs) seleccionen a las células B en el estadio del centroc1to (6).
como el ligando de C040 y el CD28 que interac túan en la célula B con CD40 y B7 respectiva mente (5). El proceso parece activarse en el estadio del
centroblasto para que posterior mente las células dendríticas foliculares (FDCs) seleccionen a las células B en el estadio del centroc1to (6).

