Introducción
Los recién nacidos críticamente enfermos en la UCIN se enfrentan a diversas situaciones (ej. prematurez, ototoxicidad) que los hacen más propensos a presentar comorbilidades, entre ellas la hipoacusia neonatal. (Pourarian, et al., 2012). Ésta, es la discapacidad congénita más frecuente en el mundo (Butcher et al., 2019) y se estima que 80% de las sorderas infantiles permanentes están presentes desde el nacimiento (Wroblewska-Seniuk et al., 2017).
La detección oportuna de la hipoacusia neonatal es un reto de salud pública, por lo que se ha implementado un tamizaje auditivo universal. Gracias a su implementación, la edad media del diagnóstico de hipoacusia paso de 2.5 años a 2 meses (Zazove et al., 2020). Lo cual, se asocia a menos casos de sordera permanente.
Existen factores de riesgo que se asocian a tasas más altas de hipoacusia neonatal. Estos factores varían entre poblaciones. Por lo general, son características que observamos en recién nacidos en la UCIN: uso de ventilación mecánica, bajo APGAR al nacer o uso de fototerapia por hiperbilirrubinemia (Acar et al., 2015). Es muy importante documentar los factores de riesgo de hipoacusia neonatal en nuestra población, ya que esto nos permitirá identificar los potenciales casos que se beneficiarían de un segundo tamizaje en el seguimiento, aunque el primer tamiz fuese catalogado como “normal”. Esta estrategia podría aumentar la capacidad de diagnóstico de hipoacusia neonatal y con ello disminuir la carga de la enfermedad. Es por esto que nuestro objetivo es determinar los factores asociados a un tamiz auditivo anormal en las primeras 72 horas.
1. Materiales y métodos
1.1. Diseño del estudio y recolección de datos
Se realizó un estudio retrospectivo, transversal y unicéntrico. Se incluyeron nacidos vivos de entre 24-42 semanas (por Capurro y Billard) que ingresaron a la UCIN en el Hospital Regional “General Ignacio Zaragoza” ISSSTE entre agosto del 2018 y abril del 2019. Los pacientes se sometieron a tamiz auditivo en las primeras 72 horas de su ingreso a la UCIN.
1.2. Tamiz auditivo
El tamiz auditivo se realizó en la cuna radiante del paciente, usando un equipo portátil interacoustics® otoread™. Se realizaron emisiones otacústicas de productos de distorsión en frecuencias de 2-5 kHz en cuatro bandas con intensidad de 20 a 90 dB. El procedimiento fue realizado por personal profesional entrenado. El resultado de la audiometría se dividió en audición “normal” y “no normal”. Cuando los pacientes tenían un resultado “no normal”, se referían a estimulación temprana para realizar potenciales auditivos evocados.
1.3. Cálculo de muestra
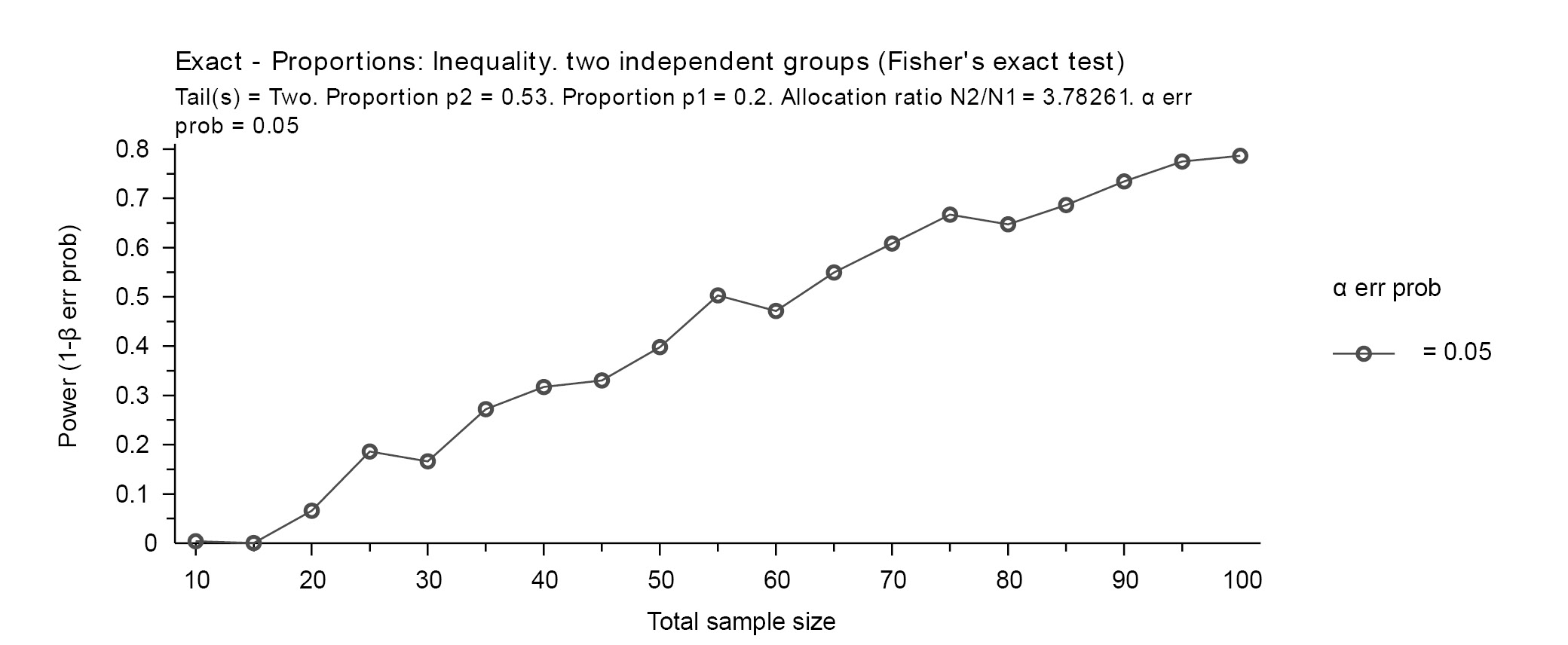
Calculamos el poder posthoc con la muestra total de 110 neonatos usando el programa G*power. Para calcular la potencia de nuestro estudio para encontrar factores asociados a tamiz neonatal anormal usamos una fórmula de diferencia de proporciones de dos colas, un error alfa del 5%, y una diferencia de proporciones de 0.3 pudimos alcanzar una potencia del 80%. (Figura 1).
Figura 1.
Cálculo de muestra
1.4. Análisis estadístico
Usamos el programa Excel para hacer la base de datos y el programa SPSSstatistics v26 para el análisis estadístico. Documentamos la normalidad de las variables con una prueba de Shapiro-Wilk. Por la distribución no normal de las variables, usamos mediana y rango para describir las variables cuantitativas. Describimos con frecuencia y porcentaje las variables categóricas. Usamos U de Mann Whitney para comparar las medianas de peso neonatal y chi cuadrada de Pearson para comparar las variables categóricas entre el grupo de tamiz auditivo anormal y normal. Para obtener los factores asociados a un tamiz auditivo anormal usamos tablas 2x2, odds ratio e intervalos de confianza del 95%. Todas las pruebas fueron bivariadas y un valor de p=0.05 se consideró significativo. No se admitieron valores perdidos en el análisis.
2. Resultados
Incluimos a un total de 110 recién nacidos que se realizaron el tamiz neonatal auditivo. La frecuencia de un resultado de tamiz anormal fue de 20.9% (n=23). Hicimos una comparación entre las principales características clínicas de los pacientes entre el grupo con tamiz auditivo anormal y normal; la información se presenta en la tabla 1. El género, peso para la edad gestacional, semanas de gestación, APGAR, hiperbilirrubinemia multifactorial, hipoglucemia, hipocalcemia e hiponatremia fueron similares entre los recién nacidos con tamiz anormal y normal (p>0.05). La proporción de recién nacidos con crisis convulsivas (12.6% vs. 65.2%) y displasia broncopulmonar (1.1% vs. 13%) fueron mayores en el grupo con tamiz auditivo anormal (p<0.05). También, los recién nacidos con un tamiz anormal tuvieron una mediana de peso al nacer menor ─1.94 kg vs 1.78 kg─ (p=0.04).
Tabla 1.
Principales características de los pacientes y comparación entre los productos con y sin hipoacusia congénita
|
|
Tamiz auditivo normal (n=87, 79.1%) |
Tamiz auditivo anormal (n=23, 0.9%) |
||||
|
n |
% |
n |
% |
p |
||
|
Género (n,%) |
Mujer |
42 |
48.30% |
11 |
47.80% |
0.969
|
|
Hombre |
45 |
51.70% |
12 |
52.20% |
||
|
PEG (n,%) |
PAEG |
53 |
60.90% |
15 |
65.20% |
0.763
|
|
PBEG |
32 |
36.80% |
7 |
30.40% |
||
|
Peso alto para edad gestacional |
2 |
2.30% |
1 |
4.30% |
||
|
Fototerapia (n,%) |
Ausencia |
25 |
28.70% |
3 |
13.00% |
0.179
|
|
Presencia |
62 |
71.30% |
20 |
87.00% |
||
|
Asfixia (n,%) |
Ausencia |
80 |
92.00% |
20 |
87.00% |
0.458
|
|
Presencia |
7 |
8.00% |
3 |
13.00% |
||
|
Sepsis (n,%) |
Ausencia |
44 |
50.60% |
13 |
56.50% |
0.612
|
|
Presencia |
43 |
49.40% |
10 |
43.50% |
||
|
Ventilación mecánica (n,%) |
Ausencia |
52 |
59.80% |
9 |
39.10% |
0.07
|
|
Presencia |
35 |
40.20% |
14 |
60.90% |
||
|
Antibióticos ototóxicos (n,%) |
Ausencia |
55 |
63.20% |
15 |
65.20% |
0.85
|
|
Presencia |
32 |
36.80% |
8 |
34.80% |
||
|
Crisis convulsivas (n,%) |
Ausencia |
76 |
87.40% |
8 |
34.80% |
0.0001
|
|
Presencia |
11 |
12.60% |
15 |
65.20% |
||
|
Estancia en UCIN a los 5 días (n,%) |
Ausencia |
37 |
42.50% |
12 |
52.20% |
0.4
|
|
Presencia |
50 |
57.50% |
11 |
47.80% |
||
|
SAP (n,%) |
Ausencia |
79 |
90.80% |
21 |
91.30% |
0.94
|
|
Presencia |
8 |
9.20% |
2 |
8.70% |
||
|
Preeclampsia (n,%) |
Ausencia |
85 |
97.70% |
22 |
95.70% |
0.59
|
|
Presencia |
2 |
2.30% |
1 |
4.30% |
||
|
DM gestacional (n,%) |
Ausencia |
85 |
97.70% |
23 |
100.00% |
0.46
|
|
Presencia |
2 |
2.30% |
0 |
0.00% |
||
|
SDR (n,%) |
Ausencia |
36 |
41.40% |
12 |
52.20% |
0.35
|
|
Presencia |
51 |
58.60% |
11 |
47.80% |
||
|
HELLP (n,%) |
Ausencia |
85 |
97.70% |
23 |
100.00% |
0.46
|
|
Presencia |
2 |
2.30% |
0 |
0.00% |
||
|
Incompatibilidad ABO (n,%) |
Ausencia |
82 |
94.30% |
23 |
100.00% |
0.239
|
|
Presencia |
5 |
5.70% |
0 |
0.00% |
||
|
TTRN (n,%) |
Ausencia |
71 |
81.60% |
22 |
95.70% |
0.09
|
|
Presencia |
16 |
18.40% |
1 |
4.30% |
||
|
Hipoglicemia (n,%) |
Ausencia |
82 |
94.30% |
21 |
91.30% |
0.6
|
|
Presencia |
5 |
5.70% |
2 |
8.70% |
||
|
Hiperbilirrubinemia multifactorial (n,%) |
Ausencia |
47 |
54.00% |
12 |
52.20% |
0.87
|
|
Presencia |
40 |
46.00% |
11 |
47.80% |
||
|
ROP (n,%) |
Ausencia |
84 |
96.60% |
21 |
91.30% |
0.28
|
|
Presencia |
3 |
3.40% |
2 |
8.70% |
||
|
Hipocalcemia (n,%) |
Ausencia |
74 |
85.10% |
18 |
78.30% |
0.43
|
|
Presencia |
13 |
14.90% |
5 |
21.70% |
||
|
Hiponatremia (n,%) |
Ausencia |
82 |
94.30% |
22 |
95.70% |
0.79
|
|
Presencia |
5 |
5.70% |
1 |
4.30% |
||
|
DBP (n,%) |
Ausencia |
86 |
98.90% |
20 |
87.00% |
0.007
|
|
Presencia |
1 |
1.10% |
3 |
13.00% |
||
|
Oído afectado (n,%) |
Izquierdo |
0 |
0.00% |
3 |
13.00% |
NA
|
|
Derecho |
0 |
0.00% |
5 |
21.70% |
||
|
Ambos |
0 |
0.00% |
15 |
65.20% |
||
|
Termino (n,%) |
Ausencia |
69 |
79.30% |
17 |
73.90% |
0.577
|
|
Presencia |
18 |
20.70% |
6 |
26.10% |
||
|
SDG (mediana, rango) |
Semanas |
34 |
26.4-41 |
33 |
25-40 |
0.11 |
|
Peso (mediana, rango) |
kg |
1.945 |
0.74-3.7 |
1.78 |
0.64-3.95 |
0.04 |
|
APGAR 1 minuto (mediana, rango) |
Puntos |
8 |
1,9 |
7 |
0-9 |
0.42 |
|
APGAR 5 minutos (mediana, rango) |
Puntos |
9 |
5,9 |
9 |
3,9 |
0.62 |
Nota. PEG (peso para la edad gestacional), PAEG (peso adecuado para la edad gestacional), PBEG (peso bajo para la edad gestacional), SAP (síndrome de mala adaptación pulmonar), DM (diabetes mellitus), SDR (síndrome de distrés respiratorio), TTRN (taquipnea transitoria del recién nacido), ROP (retinopatía del prematuro), DBP (displasia broncopulmonar), SDG (semanas de gestación).
En la tabla 2 reportamos los factores asociados a la presencia de un tamiz auditivo anormal. La presencia de crisis convulsivas (OR=13, IC95% 4.5-37.6) y la presencia de displasia broncopulmonar (OR=12.9, IC95%, 1.3-130.6) fueron las únicas dos variables que se asociaron a un tamiz auditivo anormal. Un peso mayor a 2.2kg al nacer fue el único factor que se asoció de forma negativa de forma significativa (OR=0.77, IC95%, 0.68-0.87) con un tamiz auditivo anormal. El género masculino, nacimiento a término, uso de fototerapia, asfixia, sepsis, ventilación mecánica, uso de ototóxicos y estancia mayor de 5 días en UCIN, no fueron variables asociadas a la presencia de un tamiz auditivo anormal.
Tabla 2.
Factores asociados a un tamiz auditivo anormal.
|
|
OR |
IC95% |
|
Género (masculino) |
1.01 |
0.4-2.5 |
|
Peso mayor a 2.2kg |
0.77 |
0.68-0.87 |
|
Producto a término |
1.4 |
0.46-3.9 |
|
Uso de Fototerapia |
2.7 |
0.7-9.8 |
|
Asfixia |
1.7 |
0.4-7.2 |
|
Sepsis |
0.8 |
0.3-2 |
|
Ventilación mecánica |
2.3 |
0.9-5.9 |
|
Uso de antibióticos ototóxicos |
0.92 |
0.4-2.4 |
|
Crisis convulsivas |
13 |
4.5-37.6 |
|
Estancia en UCIN ≥5 días |
0.7 |
0.3-1.7 |
|
SAP |
0.94 |
0.2-4.7 |
|
Preeclampsia |
1.9 |
0.2-22.3 |
|
SDR |
0.64 |
0.25-1.6 |
|
TTRN |
0.2 |
0.03-1.6 |
|
Hipoglicemia |
1.6 |
0.3-8.6 |
|
Hiperbilirrubinemia multifactorial |
1.1 |
0.4-2.7 |
|
ROP |
2.7 |
0.4-17 |
|
Hipocalcemia |
1.6 |
0.5-5 |
|
Hiponatremia |
0.7 |
0.08-6.7 |
|
DBP |
12.9 |
1.3-130.6 |
Nota. SAP (síndrome de mala adaptación pulmonar), SDR (síndrome de distrés respiratorio), TTRN (taquipnea transitoria del recién nacido), ROP (retinopatía del prematuro), DBP (displasia broncopulmonar).
En la tabla 2 presentamos los odds ratio e intervalos de confianza del 95% de las características del recién nacido, antecedentes relavantes de la madre, y complicaciones.
3. Discusión
En nuestra población de recién nacidos en la UCIN, la prevalencia de un tamiz auditivo anormal fue del 20.9%. En nuestro estudio, la presencia de crisis convulsivas neonatales y de displasia broncopulmonar se asoció 13 veces más a un tamiz auditivo anormal. Los recién nacidos con peso bajo tenían con más frecuencia un tamiz anormal mientras que un peso neonatal mayor a 2.2 kg se asoció a tamiz normal.
La frecuencia de hipoacusia en niños con historia de ingreso a UCIN en México, se ha estimado entre el 6 y el 13% (Milanes, Silva y Angulo, 2013). La implementación de tamizaje auditivo universal, logró que la edad media del diagnóstico de hipoacusia neonatal se redujera a dos meses (Milanes, Silva y Angulo, 2013; Borkoski et al., 2017). Además, mediante el tamizaje universal se ha encontrado una prevalencia de hipoacusia congénita permanente de 112 por 100 mil neonatos, con una mayor proporción en los que tienen factores de riesgo (62 por 100 mil) que en los que no los tienen (54 por 100 mil) (Borkoski et al., 2017). Es por esto que es importante detectar factores de riesgo y realizar tamizaje auditivo universal para detectar esta patología oportunamente, ya que se considera que es la principal causa de discapacidad (Corujo-Santana et al., 2015; Grosse et al., 2018).
Existen diferentes factores de riesgo asociados a hipoacusia neonatal. Uno de ellos es el peso al nacer <1.5 kg (Núnez-Batalla et al., 2012; Gohari et al., 2020). Este hallazgo se replicó en nuestro estudio; los pacientes con tamiz auditivo positivo pesaban menos (1.78 kg vs 1.94 kg) que los que tuvieron un tamiz normal (p=0.04) y el valor de corte de peso ≥ 2.2kg tuvo una asociación protectora para presentar un tamiz positivo. Sin embargo, al dividir a los pacientes en el peso para la edad gestacional (peso adecuado, alto y bajo) no hubo diferencias significativas entre grupos (p=0.763).
Las convulsiones neonatales también se han asociado a mayor riesgo de desarrollar hipoacusia neonatal y permanente. En un estudio realizado en Irán, reportaron que las convulsiones se asociaron tres veces más a sordera neurosensorial en niños (OR=3.02, p<0.05) (Afshar et al., 2022). Murray y colaboradores, también demostraron que las crisis convulsivas antes de la oxigenación por membrana extracorpórea (ECMO) se asociaron de manera independiente a pérdida auditiva neurosensorial (Murray et al., 2011). Este hallazgo se replicó en nuestro estudio; de hecho, fue el factor que más asociación tuvo con un tamiz auditivo anormal. Sería interesante dar seguimiento a estos pacientes y documentar si desarrollan hipoacusia permanente. Este hallazgo es importante, ya que en muchas ocasiones las crisis convulsivas pueden ser prevenibles y reversibles (ej. hipoglucemia).
De manera interesante, también reportamos que los pacientes con un tamiz auditivo anormal tenían con mayor frecuencia displasia broncopulmonar (p=0.007) y que incluso esta se asoció 13 veces más a presentar un tamiz auditivo anormal.
Algunos otros factores de riesgo que se han reportado son: recién nacidos pretérmino, uso de ototóxicos, puntuación APGAR baja, requerimiento de ventilación mecánica superior a 5 días, estancia en UCIN mayor de 5 días, anormalidades del pabellón auricular e hiperbilirrubinemia que requiera fototerapia o exanguinotransfusión (Núñez et al., 2012; Turchetta et al., 2018). En nuestro estudio, todos los pacientes eran pretérmino; el uso de ototóxicos, el APGAR al minuto y a los 5 minutos, la frecuencia de hiperbilirrubinemia multifactorial y necesidad de fototerapia fueron similares entre grupos (p>0.05). Los pacientes con tamiz auditivo anormal tuvieron una mayor proporción de uso de ventilación mecánica (60.9% vs 40.2%) sin embargo no logró significancia (p=0.07).
La importancia de realizar tamizaje auditivo universal radica en que: 1) la hipoacusia es una patología frecuente en recién nacidos críticamente enfermos (con y sin antecedente familiar de hipoacusia), 2) Existen factores prevenibles asociados a hipoacusia neonatal (ej. crisis convulsivas por hipoglucemia) y 3) la mayoría de los casos de hipoacusia permanente (80%) están presentes desde el nacimiento (Wroblewska-Seniuk et al., 2017). Por lo que, la búsqueda intencionada de hipoacusia neonatal y la detección de factores de riesgo son muy importantes para prevenir secuelas posteriores y disminuir la carga de la enfermedad. Conocer los factores de riesgo, permite identificar a pacientes de alto riesgo que, aunque pasen el tamizaje inicial, aún tienen posibilidad de desarrollar hipoacusia tardía (Benito y Silva, 2013).
En un estudio realizado en 92 recién nacidos ingresados en la UCIN, reportaron que los pacientes que tenían un tamiz auditivo anormal (emisiones otoacústicas + potenciales evocados) eran con más frecuencia prematuros, con peso bajo al nacer, uso de ototóxicos por más de 5 días, hiperbilirrubinemia, sepsis, asfixia perinatal y uso de ventilación mecánica por más de 5 días (Aradhana et al., 2020). En nuestro estudio, no encontramos una asociación significativa entre asfixia perinatal, hiperbilirrubinemia, y un tamiz neonatal anormal. Probablemente al incluir más pacientes a nuestro estudio podríamos identificar más factores asociados a un tamiz auditivo anormal. De hecho, el único factor asociado de forma negativa a un tamiz auditivo anormal fue el peso al nacer mayor de 2.2kg.
En esta serie de pacientes, los factores que se asociaron de forma independiente a un tamiz neonatal anormal fueron: crisis convulsivas y displasia broncopulmonar. Ambas patologías son muy frecuentes en pacientes ingresados a la UCIN por lo que es de importancia conocer que, en nuestra población, estas dos patologías se asocian a un tamiz auditivo neonatal anormal. Esto, porque en muchas ocasiones las crisis convulsivas pueden ser prevenibles (ej. hipoglucemia, hipotermia, sepsis).
En nuestro estudio, el género no se asoció a un tamiz auditivo anormal. Esto es similar a estudios previos realizados (Pourarian et al., 2012; Aradhana et al., 2020; Swain et al., 2017). De igual forma, el uso de ototóxicos no se asoció a un tamiz auditivo anormal, aunque en este tema hay estudios contradictorios. Existen algunos que reportan que, si hay una correlación significativa entre el uso de ototóxicos con alteraciones auditivas, y otros en donde no se establece esta relación (Aradhana et al., 2020; Hrnčić, 2018).
La prematurez, ha sido reportado como el principal factor asociado a un tamiz auditivo anormal (Aradhana et al., 2020; Escobar-Ipuz et al., 2019; Swain et al., 2017). En nuestro estudio, todos los pacientes tenían menos de 34 SDG, ya que todos se encontraban en la UCIN. Los pacientes críticamente enfermos que se encuentran en la UCIN tienen con mayor frecuencia un tamiz auditivo anormal y se ha reportado que la asfixia perinatal y la hiperbilirrubinemia son factores de riesgo (Kumar Gupta y Sinha, 2017). En nuestro estudio, ambos padecimientos se encontraron con frecuencia en los pacientes, sin embargo, ninguno se asoció a un tamiz auditivo anormal.
La aportación de este estudio es que, en una serie de neonatos prematuros en la UCIN, las crisis convulsivas se asociaron a un tamiz auditivo anormal (OR=13, IC95%, 4.5-37.6). Esto es importante, ya que en muchas ocasiones la etiología de las crisis convulsivas es prevenible (ej. hipoglucemia, hipotermia).
3.1. Limitaciones
Este estudio tiene múltiples limitaciones. Nuestra muestra está conformada en su totalidad por pacientes prematuros y críticamente enfermos en la UCIN, por lo que no podemos generalizar los resultados a toda la población. También, tenemos un tamaño de muestra limitado por lo que los resultados deben de ser considerados preliminares. Estudios con un tamaño de muestra más grande podrían confirmar nuestros hallazgos.
3.2. Alcances y perspectivas
Este estudio provee información epidemiológica importante ya que en México existe información limitada.
4. Conclusiones
En nuestro estudio la prevalencia de un tamiz neonatal anormal fue elevada (20.9%) y los factores asociados a un tamizaje anormal fueron la presencia de crisis convulsivas neonatales, y displasia broncopulmonar. Estos hallazgos son similares a lo reportado en otros estudios. Los pacientes con estas características podrían beneficiarse de seguimiento más estrecho con audiometría. En este estudio, el único factor protector para un tamiz auditivo anormal fue la presencia de un peso al nacer mayor de 2.2kg. Sin embargo, este estudio es retrospectivo y puede contener sesgos de información. Por lo tanto, la información es preliminar. Sería útil realizar un estudio con una muestra más grande para reproducir los resultados.
Agradecimientos
Agradecemos al personal clínico de la UCIN del Hospital Regional “General Ignacio Zaragoza” ISSSTE.
Fuentes de financiamiento
Se utilizaron recursos propios del servicio del Hospital Regional “General Ignacio Zaragoza” ISSSTE.
Declaratoria de disponibilidad de datos
Los datos recabados y utilizados en el estudio no son públicos y no se encuentran en ningún repertorio digital.