Obtención de (Nanocilindros) de TiO 2 dirigido por ADN mediante sol-gel
M en C. Humberto A. Monreal, Dr. Martínez Villafañe & Dr. José G. Chacón Nava Centro de Investigación en Materiales Avanzados, S.C.
Chihuahua, Chih. Méx.
Email: humberto.monreal@cimav.edu.mx
Dr. Martínez-Villafañe
Dr. Daniel Glossman Mitnik, Dr. Carlos A. Martínez & Dra. Perla G. Casillas Instituto de Ingeniería y Tecnología, U.A.C.J.
Cd. Juárez, Chihuahua, Méx.
Recibido: Febrero del 2005, Aceptado: Abril del 2005.
RESUMEN
En este trabajo sintetizamos nanocilindros de dióxido de titanio de 30 a 400 nm por medio de ADN del plásmido pBR322 de 4,362 pares de bases y el uso de isopropóxido de titanio como precursor por medio del proceso sol-gel. Los geles resultantes fueron calcinados y los polvos caracterizados por medio de Microscopio Electrónico de Barrido (MEB), Espectroscopía de Energía Dispersiva, Microscopio Electrónico de Transmisión (MET) y Difracción de Rayos X. Los resultados muestran que la síntesis in vitro de nanorods en presencia de ADN, puede ser activada. Muchas otras moléculas sintéticas pueden producirse por medio del uso de sistemas orgánicos, es así como reportamos la síntesis de híbridos hechos de ácidos nucleicos en materiales inorgánicos que pueden tener diversas aplicaciones en sistemas catalíticos, biomateriales y materiales nanoestructurados.
Palabras clave: Nanocilindros, sol-gel, ADN, dióxido de titanio.
ABSTRACT
In this work, we have synthetized titanium dioxide nanorods ranging in size from about 30 nm up to 400 nm by means of DNA plasmid pBR322 (4,362 base pairs) and using titanium isopropoxide as a precursor through the sol-gel process. The resulting gels were calcinated and the powders characterized by means of Scanning Electron Microscopy, Energy Dispersive Spectroscopy, Transmission Electron Microscopy, and X-Ray Diffraction. The results show that the synthesis in vitro of nanorods in the presence of DNA can be achieved. Many other synthetic molecules can be produced by means of the use of organic systems. Thus, we report the synthesis of hybrids made of nucleic acids in inorganic materials that may have several applications as catalytic systems, biomaterials and nanostructured materials.
Keywords: Nanorods, sol-gel, DNA, titanium dioxide.
INTRODUCCIÓN
El entendimiento de los niveles moleculares en la síntesis de nuevos materiales se ha incrementado gracias a la generación de nanomateriales, al diseño y fabricación de nanodispositivos en la escala molecular y al auto ensamblaje de diversos metales en sístemas biológicos [1]. El ensamblaje molecular es una herramienta importante en las décadas futuras, de esta manera los principios básicos para la micro fabricación pueden entenderse mediante el fenómeno del auto reconocimiento que se encuentra en la naturaleza. La llave en los elementos del auto ensamblaje son la complementariedad química y la compatibilidad estructural de interacciones no covalentes [1]. Asimismo, se han desarrollado numerosos sistemas de auto ensamblaje como modelos de estudio del plegamiento de proteínas y la conformación de las proteínas en diversas enfermedades, para electrónica molecular, ingeniería de superficie y nanotecnología [1]. El advenimiento de la biotecnología y la ingeniería genética, acoplada con los recientes avances en la química de ácidos nucleicos y la síntesis de péptidos, es el resultado de un cambio conceptual en el desarrollo de nuevos materiales [2,3]. La adición de cationes monovalentes y polivalentes como el péptido poli L-lisina, o la introducción de soluciones con péptidos dentro de medios fisiológicos, producen que éstos oligopéptidos se ensamblen espontáneamente para formar estructuras microscópicas y macroscópicas que pueden fabricarse dentro de formas geométricas [4]. Uno de los sistemas de auto ensamblaje propuesto como modelo de estudio es el formado por el péptido poli L-lisina, donde las cargas positivas de éste interactúan con las cargas negativas del glutamato, formando estructuras moleculares beta plegadas [5]. De esta forma, se reporta un sistema modelo en solución de cetiltrimetilamonio, al que se le añaden moléculas de ADN para formar estructuras laminares, en donde las cargas negativas del ADN interactúan con las cargas positivas del cetiltrimetilamonio [6]. Por estas razones se justifica el uso de macromoléculas biológicas como el ADN de diferente origen, ya sea ADN viral, cromosomal, plásmidico, etc., proteínas sintéticas o naturales, oligonúcleotidos, aminoácidos y péptidos por mencionar algunos, en tanto que estas moléculas poseen la capacidad de reconocer selectivamente, pudiendo unirse a otras especies para formar diferentes complejos como nanopartículas, nanotubos, nanocilindros, entre otros. En este trabajo en particular se diseño el experimento con ADN plasmídico, ya que sólo utilizamos al ADN para que tenga un efecto de plantilla al añadir el precursor metálico, sin tener particular interés en sus características genéticas. Usamos particularmente el precursor de titanio porque estamos interesados en la síntesis de biomateriales que tengan aplicaciones biomédicas, como la producción de prótesis; en este caso, el titanio posee la característica de ser un material biocompatible e inocuo en el organismo, por lo que se escoge para la obtención de los nanocilindros. Los resultados que se muestran en este trabajo son de gran importancia, pues se pretende que sean utilizados en la síntesis de diferentes estructuras usando diversos precursores metálicos dependiendo del interés de cada grupo de investigación.
MATERIALES Y MÉTODOS
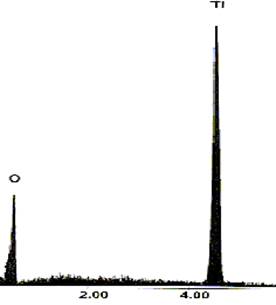
El procedimiento de síntesis de nanocilindros de dióxido de titanio, en presencia de ADN circular se diseño de la siguiente forma: los nanocilindros de dióxido de titanio, fueron preparados en solución formando el sol de titanio, en etanol seguido por procesos de secado y tratamiento térmico. Con una micro pipeta se preparó una solución de isopropóxido de titanio (Sigma Aldrich cat. 205273, 1 M, en etanol absoluto pH 5.2 marca Sigma Aldrich cat. E702-3) y se añadió 10 µl de la solución, dentro de un tubo de 1 ml; de esta manera se adicionó, gota a gota 5 µg de ADN del plásmido pBR322 (35 µl) (marca Sigma Aldrich grado biología molecular cat. D-9893 Lot. 41k9049) y 50 µl de agua bidestilada (marca Pisa pH 7.0 ) para formar el gel, la muestra se incubó a 4º C por 10 días para evitar la rápida degradación del ADN y secar el gel. Posteriormente, la muestra se calcinó a 700ºC por tres horas, y los polvos recuperados se analizaron mediante microscopio electrónico de barrido, análisis de energía dispersiva de rayos x, microscopio electrónico de transmisión y difracción de rayos x.
RESULTADOS Y DISCUSIÓN
En la imagen de la figura 1(a) en MEB se muestra claramente la formación de los nanocilindros de dióxido de titanio en presencia de ADN, los nanocilindros tienen una forma tubular con diámetros aproximados de 400 nanómetros. La evaporación del etanol causa enriquecimiento de surfactante catiónico junto con el anión del ADN, de esta manera las cadenas del ADN se orientan perpendicularmente con las cadenas alquílicas del catión originando una atracción electrostática y una estabilidad termodinámica [6]. El surfactante catiónico de las cadenas alquílicas en este caso no sólo promueven el ensamblaje sino también proveen la fuerza electrostática necesaria para mantener la conformación de las cadenas del ADN [6]. El grado de homogeneidad de los nanocilíndros depende ligeramente de la velocidad de evaporación del solvente así como de la presencia del ADN durante el proceso de síntesis, como se demostró en estudios de reproducibilidad al realizar un experimento control en ausencia de ADN. Véase la figura 1(b).

Fig. 1(a) Imagen de microscopio electrónico de barrido de nanocilindros de dióxido de titanio después de calcinar a 700° C.

Fig. 1(b) Imagen de microscopio electrónico de barrido de dióxido de titanio en ausencia de ADN.
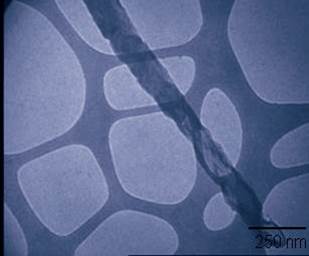
En la figura 2 se muestran las imágenes de microscopía electrónica de transmisión en modo de campo claro, en la imagen (a) se observa la presencia de nanocilindros de dióxido de titanio en presencia de ADN, con un diámetro de 30 nanómetros. Se aprecia que dicho nanocilindro presenta en su parte inferior una curvatura; en la imagen (b) de la misma figura, se presenta otro nanocilindro con un diámetro aproximado de 130 nanómetros, se observa que en su superficie se forma un aspecto rugoso el cual tiende a ser igual a lo largo del nanocilindro.

 1000
1000