Irene Montalvo Velarde
Investigadora. Escuela de Ciencias Químicas Universidad La Salle.
Mardya López Alarcón
Unidad de Investigación en Nutrición Instituto Mexicano del Seguro Social.
René Casique Salvatierra Escuela de Ciencias Químicas Universidad La Salle.
Recibido : Agosto de 2005. Aceptado: Octubre de 2005
RESUMEN
Los valores séricos son el indicador comúnmente usado para conocer el estado de vitaminas A y E. Desafortunadamente, su uso es impráctico en evaluaciones poblacionales, debido a que involucra la toma de sangre venosa, centrifugación y almacenamiento en congelación antes de su análisis. El objetivo de este estudio fue validar el uso de gotas de sangre seca (GSS) para la evaluación de vitaminas A y E, comparándolas con el retinol y tocoferol en suero venoso y capilar. Muestras de sangre venosa (SV) y capilar (SC) y GSS capilar (GSSC) se tomaron simultáneamente de 27 donadores adultos sanos. Las muestras de sangre, tanto de GSS como de suero, se prepararon y se mantuvieron a -70ºC hasta su análisis por HPLC. Las diferencias entre las muestras individuales fueron calculadas por análisis de varianza (ANOVA). El Coeficiente de Correlación de Pearson se calculó para estimar el grado de varianza de las concentraciones tanto de retinol como de tocoferol de las diferentes muestras. Las correlaciones para retinol fueron: SV/SC = 0.89; SV/GSSC = 0.85 y SC/GSSC = 0.88; para tocoferol fueron: SV/SC = 0.97; SV/GSSC = 0.94 y SC/GSSC = 0.96. El uso de esta nueva forma de muestra para evaluación de vitaminas A y E permitirá el acceso a poblaciones previamente inaccesibles.
Palabras Clave: retinol, tocoferol, gota de sangre seca, punción venosa.
ABSTRACT
The most commonly used indicator to know about vitamins A and E status is serum values. Unfortunately, its use is impractical for national surveys because it involves collection of venous blood, centrifugation and frozen storage before analysis. The objective of this study was to validate the use of dried blood spots (DBS) for vitamin A and E assessment by comparing it with venous and capillary serum retinol and tocopherol. Venous (VB), capillary blood (CB) and capillary DBS (CDBS) specimens were obtained simultaneously from 27 healthy adult volunteers. From each blood specimen, both DBS and liquid serum were prepared, and maintained at –70ºC until HPLC analysis. The differences within individuals were estimated by analysis of variance
(ANOVA). The R2 value (Square of the Pearson!s correlation coefficient was calculated
to estimate the degree of variance for one retinol or tocopherol concentration explained by the other. Correlations for retinol were: VB/CB = 0.89; VB/CDBS = 0.85 and CB/CDBS = 0.88; for tocopherol were: VB/CB = 0.97; VB/CDBS = 0.94 and CB/CDBS =
0.96. The use of this new sample matrix for vitamin A and E assessment will allow access to previously unavailable populations.
Key Words: Retinol, tocopherol, dry blood spot, venous puncture.
PLANTEAMIENTO DEL PROBLEMA
El equilibrio nutricional no es fácil de conseguir. Las desordenadas pautas alimentarias de la vida actual rompen con frecuencia ese equilibrio y ocasionan a menudo deficiencias de vitaminas (1).
Está comprobado que la actividad física y el estrés, asociados a motivos físicos o psíquicos, condicionan un aumento en las necesidades de algunos nutrimentos. La actividad diaria intensa o una situación de estrés hacen que la persona cambie sus hábitos de alimentación, fume más o consuma mayor cantidad de alcohol, por lo que la demanda de las vitaminas pueden hacerse mayores (1).
La mala nutrición que resulta del consumo deficiente de alimentos o nutrimentos específicos, se conoce genéricamente como desnutrición. La desnutrición tiene como causas biológicas inmediatas la ingestión dietética inadecuada y la elevada incidencia de enfermedades infecciosas y parasitarias que aumentan las necesidades de algunos nutrimentos, disminuyen su absorción o provocan pérdidas de micronutrimentos. La desnutrición afecta principalmente a los niños durante los primeros tres años de vida, aunque la deficiencia de varios micronutrimentos también se presenta durante la edad escolar y en mujeres en edad fértil (2).
La desnutrición provoca defectos en funciones como el crecimiento y el desarrollo psicomotor, con mayor riesgo de morbilidad y mortalidad y con efectos adversos a largo plazo (3,4).
Si antes se pensaba que el aporte de los micronutrimentos era fundamental para prevenir las enfermedades que su carencia podría generar, ahora se sabe que estos micronutrimentos desempeñan un importante papel en la prevención de otras enfermedades, como la patología cardiovascular y el cáncer, e incluso para retrasar el envejecimiento (1).
Dentro de las vitaminas liposolubles, la vitamina A participa en la visión, en el crecimiento, en el desarrollo de los huesos, en el mantenimiento del tejido epitelial (piel, pelo, uñas, mucosas respiratorias y de los ojos, etc.), y en los procesos inmunitarios para evitar las infecciones. La deficiencia de esta vitamina puede ocasionar desde ceguera nocturna hasta Xeroftalmia ocasionando ceguera permanente (5).
La vitamina E, también llamada Tocoferol es importante para la reproducción normal, el desarrollo muscular y la cicatrización de las llagas, tiene una acción antioxidante y ayuda a proteger las membranas de los glóbulos rojos (6).
Su deficiencia ocasiona esterilidad en machos de algunas especies y abortos espontáneos y resorción de fetos en hembras, degeneración muscular, anemias y lesiones hepáticas y renales. Además guarda relación con el proceso de envejecimiento. Se almacena en el organismo durante largos periodos de tiempo, así que no es frecuente tener deficiencias importantes. Se considera una sustancia no tóxica excepto en los pacientes con hipotensión y cardiopatía reumática crónica (6).
En la Encuesta Nacional de Nutrición 1999 (7), recientemente publicada, las principales deficiencias de micronutrimentos tanto en niños preescolares y escolares y en mujeres embarazadas se encontraron en Fe y Zn; las deficiencias de vitamina A (retinol) y Vitamina E (tocoferol) y ácido fólico, se encontraron principalmente en mujeres embarazadas.
Sin embargo, la deficiencia de retinol en países asiáticos y africanos es verdaderamente importante, con las manifestaciones graves de su deficiencia como xeroftalmia juvenil, queratomalacia, manchas de Bitot, ceguera nocturna o ceguera total, permitiendo que los niños y mujeres jóvenes sean más vulnerables a la enfermedad, ya que cerca de 150 millones de niños tienen deficiencia subclínica de vitamina A (8).
En cuanto a la deficiencia de tocoferol no existe suficiente información que demuestre que es un problema grave de salud pública, sin embargo, dada la importancia que tiene como antioxidante dentro de las funciones del organismo, su estudio se justifica plenamente.
El conocimiento de las deficiencias de micronutrimentos en poblaciones, permite la intervención de suplementos que mejoren este estado, y por lo tanto, el buen desarrollo de los individuos.
El análisis convencional de retinol y tocoferol requiere de muestras de sangre venosa a las que posteriormente se separa el suero para hacer las determinaciones. Este procedimiento en estudios de campo es impráctico, ya que requiere de personal lo suficientemente entrenado para tomar muestras por punción venosa, una cantidad de sangre suficiente para obtener de ella la cantidad necesaria de suero para las determinaciones. El temor a las agujas, al riesgo de la transmisión y adquisición de enfermedades virales vía venosa (hepatitis crónica, SIDA) y/o creencias religiosas, son factores que pueden excluir a muchos de los participantes del estudio. Además, este método convencional requiere de electricidad para la centrifugación de las muestras y el almacenamiento de ellas en congelación inmediata para evitar su degradación y por consiguiente la pérdida de las vitaminas, subestimando su contenido. El transporte de las muestras hasta el lugar de análisis es otro problema grave, ya que también requiere de congelación, lo que en la mayoría de los casos resulta un proceso costoso (9).
La mayoría de estos obstáculos pueden evitarse analizando manchas o Gotas de Sangre Seca (GSS) en lugar de suero venoso; de esta manera, la colecta de las muestras puede ser mucho más fácil y menos invasiva. Este procedimiento que ha sido utilizado para el análisis de marcadores bioquímicos como en la detección de fenilcetonuria en los recién nacidos, no requiere de agujas, de personal entrenado para la toma de sangre, y el potencial de transmisión de enfermedades es mínimo; además, permite el acceso a poblaciones remotas. Una vez que la sangre obtenida por punción de un dedo o del talón es depositada en los papeles filtro debidamente marcados, su transporte y almacenamiento hasta el laboratorio de análisis es fácil, ya que puede no requerir temperaturas bajo cero, con lo que se reduce importantemente su costo (10).
O´Broin y Maldonado (11,12), demostraron que el método GSS es una alternativa efectiva y viable para colectar muestras de sangre en estudios epidemiológicos, demostrando que este método fue adecuado para medición de ácido fólico en sangre.
La medición de vitamina A (retinol) en las GSS fue descrita previamente por Shi et al,
(13) usando electroforesis capilar de alta resolución (HPCE) con detección de fluorescencia, acoplada con láser. Ma et al, (14) hicieron una modificación al método anterior de HPCE, optimizando las condiciones de separación y mejorando la confiabilidad del método, demostrando la estabilidad de la vitamina A en sangre seca colectada directamente de un dedo o del talón sobre el papel filtro.
Actualmente hay poca información disponible que haga la comparación entre las concentraciones de retinol de suero de vena y capilar y GSS (8, 9) y no hay información sobre el contenido de tocoferol en estas muestras.
Además de la facilidad en la toma de muestra, la instrumentación y la experiencia para la medición son absolutamente necesarias para la validez del método de cuantificación.
JUSTIFICACIÓN DEL PROYECTO
En países subdesarrollados, existen algunas barreras para el uso de sangre venosa en estudios de campo. En primer lugar, la colecta de sangre venosa requiere de personal entrenado, en segundo lugar, debido a los tabúes locales, creencias culturales y religiosas y preocupaciones acerca de la transmisión de enfermedades, hay una resistencia a la toma de sangre venosa a través de agujas hipodérmicas. Una tercera barrera es el incremento en el riesgo de adquirir o transmitir enfermedades virales vía venosa, tales como hepatitis crónica y SIDA. Además, de que de la sangre se necesita separar el suero y esto requiere centrifugación y posteriormente transportarlo y almacenarlo en congelación hasta el lugar de análisis, lo cual es impractico en ausencia de electricidad. La mayoría de estos obstáculos pueden evitarse analizando gotas de sangre seca (GSS) en lugar de sangre venosa, ya que no requiere punción venosa ni de almacenamiento y transporte inmediato a bajas temperaturas, lo que facilita en gran medida los estudios poblacionales de estas vitaminas.
OBJETIVOS. OBJETIVO GENERAL:
Determinar si el contenido de retinol y tocoferol en suero es igual en muestras provenientes de gotas de sangre seca sobre papel filtro (GSS), en sangre venosa y en sangre capilar del mismo individuo.
OBJETIVOS PARTICULARES:
1.- Establecer las condiciones de extracción óptima de la sangre tomada sobre el papel filtro para la determinación de retinol y tocoferol.
2.- Estandarizar las condiciones cromatográficas por HPLC para determinar en una misma corrida las dos vitaminas.
3.- Comparar el contenido obtenido de las dos vitaminas provenientes de los diferentes tipos de muestras obtenidas del mismo individuo.
36 Rev. del Centro de Inv. (Méx.) Vol. 7. Núm. 25. Ene..- Jul. 2006
METODOLOGÍA.
1.- Obtención de muestras
Se analizaron 27 voluntarios sanos a los que se les tomaron muestras de sangre de la siguiente forma:
Del mismo individuo se tomó en ayunas sangre venosa (aproximadamente 5 mL), en tubos sin anticoagulante. La sangre se centrifugó a 2,500 rpm durante 15 min para separar el suero, el cual se puso en criotubos y se congeló a -70°C hasta su análisis, (Muestra SV).
Se tomó también del mismo individuo una muestra de sangre capilar por punción del dedo de una mano con una lanceta (Microtainer con 2.2 mm de penetración), colocando 4 gotas de aproximadamente 50 mL cada una sobre papel filtro (papel filtro S & S # 903); una vez que son colocadas las gotas de sangre sobre el papel filtro, se deben poner en la oscuridad y dejarlas secar durante toda la noche, una vez secas, se colocan los papeles debidamente identificados en sobres de papel manila con una bolsita de secante para evitar el exceso de humedad y se guardaron a -70°C hasta el análisis de retinol y tocoferol (Muestra GSSC), del mismo dedo se pusieron 8 gotas de sangre en un microtubo sin anticoagulante (Microtainer # 5972), el cual se centrifugó para separar el suero, y se colocó en un tubo de plástico y se congeló a -70°C hasta el análisis de retinol y tocoferol (Muestra SC).
MÉTODO DE CUANTIFICACIÓN.
a) Suero:
Se colocaron 100mL de suero (SV y SC) en tubos de poliestireno con tapón de 5 ml de capacidad, se agregaron 100mL de solución de ácido ascórbico al 0.1% y 100mL de una solución de acetato de retinol (estándar interno) en etanol a una concentración de 20
mg/100ml y 200 ml de etanol.
A cada tubo se agregaron 500mL de hexano, se taparon los tubos y se agitaron durante 1 min. con reloj en un Vortex. Para separar las fases, se centrifugaron los tubos a 2500 r.p.m. durante 10 minutos.
Se separó cuantitativamente la capa orgánica y paso a un vial de vidrio. A la capa acuosa se le hizo una segunda extracción con hexano en las mismas condiciones que a la anterior, y se juntaron las capas orgánicas.
El extracto de hexano se evaporó a sequedad bajo corriente de nitrógeno. El residuo se recuperó con 100mL de etanol, conservando la muestra fría hasta la inyección al cromatógrafo.
Las muestras se colocaron en viales en el carrusel del automuestreador del cromatógrafo y se inyectaron 20ml para la cuantificación de las vitaminas.
b) Gotas de sangre seca:
Para la determinación de las vitaminas en las manchas (GSSC) se hicieron 3 perforaciones, con una perforadora de 6.35 mm de diámetro, por cada perforación se asume que se tienen 12.5 mL de sangre, de acuerdo a un trabajo previo (12) en donde se estandarizaron estas concentraciones, por lo que en total se tendrán 37.5 mL de sangre para la determinación. Las perforaciones se colocaron en tubos de vidrio y se agregó 1 mL de buffer de fosfatos 150 mmol/L a pH de 7.8, conteniendo 0.5% de ascorbato de sodio y se extrajeron en un baño ultrasónico. Una vez extraída la sangre, se agregaron 100 mL de estándar interno (acetato de retinol en concentración conocida) y 900 mL de etanol que contenía hidroquinona como antioxidante ( 0.055%); de esta mezcla se hizo la extracción de las vitaminas de la misma forma que para el suero.
Para obtener el tiempo de máxima extracción de las vitaminas de las muestras GSS, se tomó sangre venosa de un solo individuo, se pusieron gotas sobre papel filtro en las mismas condiciones descritas anteriormente. Para la extracción se probaron 4 diferentes tiempos que fueron de 15, 30, 45 y 60 minutos de sonicación.
Todo el procedimiento tanto de extracción como de cuantificación de las vitaminas se hizo bajo luz dorada para evitar la degradación de las vitaminas.
Controles de calidad
Con el objeto de validar las mediciones realizadas, se corrieron junto con las muestras tres controles de calidad preparados a tres diferentes concentraciones de vitaminas, uno bajo, uno medio, y uno alto, tanto para retinol como para tocoferol. Estos se prepararon a partir de suero, ya sea agregando retinol y tocoferol o diluyendo con solución salina fisiológica de manera que se obtengan los tres niveles de concentración. A estas muestras control se les cuantificó su concentración exacta, analizándolos por lo menos durante 20 días consecutivos por duplicado para establecer la concentración media y sus niveles de confianza al 95% para cada suero control. Cada vez que se corrieron muestras problema, se analizaron también al principio y al final de la corrida un juego de controles de calidad para verificar la sensibilidad y la exactitud del análisis
Condiciones Cromatográficas:
Se usó un HPLC marca Waters, Modelo 600 con una bomba cuaternaria y desgasificador de solventes; con un detector programable UV/VIS Modelo 486 y un automuestreador Modelo 717 con compartimiento de muestras refrigerado. Para las corridas cromatográficas se siguieron las siguientes condiciones:
Columna |
Nova-Pak C18, 4mm de 3.9 x 150 mm, con precolumna C18. |
Fase Móvil |
Metanol grado HPLC 100%. |
Velocidad de Flujo |
1.5 mL/min. |
Detección |
0 – 2.5 minutos a 325 nm |
2.5 – 4.5 minutos a 290 nm |
Se prepararon Curvas Estándar de retinol y tocoferol en etanol. Las concentraciones Stock de las vitaminas se calcularon basadas en la Ley de Lambert y Beer usando el coeficiente de extinción de retinol de 1835 a 325 nm y el de tocoferol de 75.8 a 290 nm para corregir la pureza de las vitaminas. Las curvas estándar se utilizaron para calcular la concentración de cada vitamina en las muestras analizadas, tanto de suero como de GSS.
Para calcular los valores de retinol y tocoferol de GSS a equivalentes a retinol y tocoferol séricos se usó un factor “recuperación / volumen ajustado” (retinol o tocoferol sérico / retinol o tocoferol de GSS), que fue calculado del set de muestras analizadas. La mediana de estas relaciones se usó para ajustar la concentración de retinol y tocoferol de GSS a valores equivalentes de retinol y tocoferol séricos.
Resultados
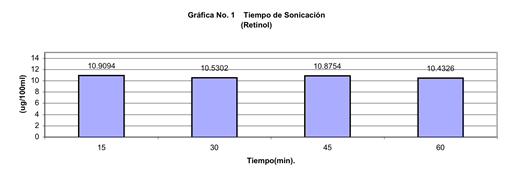
De los resultados que se obtuvieron tenemos que de las pruebas de sonicación para sacar el tiempo de máxima extracción de los compuestos por analizar se tuvieron los siguientes resultados mostrados en las gráficas 1 y 2.

Gráfica No. 2 Tiempo de Sonicación (Tocoferol)

Tiempo(min).
Como se puede ver no hubo diferencias en las concentraciones obtenidas para los 4 tiempos por lo que se decidió tomar un tiempo intermedio de 30 min para asegurar la extracción completa.
En las primeras pruebas que se hicieron para cuantificar las 2 vitaminas a partir del extracto de la sangre puesta en el sistema GSS, se vio que el tocoferol, dado su carácter de antioxidante, durante la toma de muestra y la extracción sufría una degradación por lo que no aparecía en los cromatogramas obtenidos. Para preservarlo de la oxidación se tuvo que hacer una modificación en la toma de sangre sobre los papeles filtro, impregnando estos papeles previamente con un antioxidante con el objeto de protegerlo, se probaron el ácido ascórbico y el ascorbato de sodio, a varias concentraciones, y se decidió usar el ascorbato de sodio al 0.5%, puesto que a esta concentración se obtuvieron buenos resultados de conservación.
Tabla 1. Retinol en suero venoso (SV), suero capilar (SC) y gotas de sangre seca capilar (GSSC) (m g/100mL de suero).
Individuo |
SV |
SC |
GSSC |
1 |
52.391 |
39.360 |
39.585 |
2 |
75.113 |
90.904 |
79.431 |
3 |
49.570 |
53.311 |
43.786 |
4 |
35.443 |
33.842 |
38.598 |
5 |
44.625 |
44.441 |
46.987 |
6 |
43.189 |
41.892 |
44.147 |
7 |
43.747 |
45.957 |
56.343 |
8 |
56.067 |
55.348 |
49.394 |
9 |
31.923 |
33.905 |
35.307 |
10 |
40.978 |
39.751 |
34.886 |
11 |
47.905 |
46.567 |
40.228 |
12 |
60.262 |
59.983 |
56.468 |
13 |
40.165 |
39.959 |
32.728 |
14 |
34.918 |
44.168 |
43.211 |
15 |
45.617 |
42.038 |
39.345 |
16 |
39.650 |
43.979 |
59.770 |
17 |
70.959 |
77.659 |
87.749 |
18 |
67.597 |
60.998 |
69.363 |
19 |
41.533 |
42.326 |
44.711 |
20 |
36.657 |
46.899 |
41.207 |
21 |
34.465 |
40.685 |
38.212 |
22 |
34.357 |
34.509 |
37.329 |
23 |
34.272 |
39.671 |
44.272 |
24 |
36.886 |
40.967 |
39.772 |
25 |
35.726 |
29.981 |
30.843 |
26 |
58.105 |
51.118 |
41.378 |
27 |
33.795 |
41.187 |
40.952 |
promedio |
45.404 |
46.719 |
46.519 |
desviación standar |
± 12.14 |
± 13.25 |
± 13.73 |
ANOVA P < 0.013 |
Tabla 2. Tocoferol en suero venoso (SV), suero capilar (SC) y gotas de sangre seca capilar(GSSC) (mg/100ml de suero).
Individuo |
SV |
SC |
GSSC |
1 |
1270.476 |
884.983 |
927.501 |
2 |
3136.035 |
3591.952 |
3600.468 |
3 |
1211.071 |
1338.491 |
1182.791 |
4 |
813.876 |
712.498 |
1069.023 |
5 |
1436.265 |
1432.760 |
1662.412 |
6 |
1552.947 |
1428.554 |
1625.289 |
7 |
926.745 |
980.033 |
902.750 |
8 |
1351.126 |
1320.346 |
1078.891 |
9 |
1183.768 |
1066.147 |
1327.041 |
10 |
1385.686 |
1353.532 |
1320.169 |
11 |
1703.543 |
1744.482 |
1536.352 |
12 |
918.482 |
938.068 |
859.814 |
13 |
1026.340 |
947.937 |
797.143 |
14 |
719.679 |
860.861 |
909.451 |
15 |
896.935 |
779.801 |
809.435 |
16 |
873.436 |
798.628 |
734.156 |
17 |
952.427 |
986.762 |
884.167 |
18 |
1158.841 |
1058.237 |
691.331 |
19 |
966.416 |
750.952 |
873.788 |
20 |
669.790 |
847.260 |
845.252 |
21 |
804.343 |
813.332 |
947.240 |
22 |
362.448 |
293.320 |
356.549 |
23 |
799.368 |
805.728 |
846.575 |
24 |
533.684 |
486.516 |
651.229 |
25 |
864.156 |
696.440 |
775.299 |
26 |
1188.268 |
988.521 |
883.339 |
27 |
707.202 |
719.306 |
695.291 |
promedio |
1089.38 |
1060.20 |
1066.39 |
± 514.92 |
± 594.82 |
± 590.73 |
|
ANOVA P < 0.011 |
Del análisis de las diferentes muestras de los 27 sujetos del estudio, SV, SC y GSSC, se obtuvieron los resultados que se presentan en las Tablas 1 y 2, en donde el valor de GSSC se obtuvo con el factor de “recuperación / volumen ajustado” para, con él, sacar los valores equivalentes a retinol sérico, que como podemos ver, en el promedio obtenido para cada muestra, tanto para retinol como para tocoferol, no hubo diferencias significativas de acuerdo al ANOVA realizado.
Como se describió en la metodología, cada día de análisis de muestras problema, se corrieron por duplicado los 3 controles de calidad para verificar tanto la sensibilidad como la validación de la cuantificación en todos los días de análisis, los controles de calidad estuvieron dentro de los límites de confianza obtenidos previamente, con lo que se aseguraron los resultados de las muestras problema.
Sistema |
Retinol |
Tocoferol |
SV/SC |
0.95 |
0.97 |
SV/GSSC |
0.85 |
0.94 |
SC/GSSC |
0.88 |
0.96 |
Del análisis de correlación efectuado en las 3 diferentes muestras tanto de retinol como de tocoferol se obtuvieron los resultados mostrados en la Tabla 3.
De acuerdo con el objetivo de este estudio que fue validar un método práctico y confiable como es el sistema GSS para cuantificar 2 vitaminas muy importantes para el buen funcionamiento del organismo y que fuera comprobable con las muestras de suero, podemos ver en los resultados obtenidos que hubo una alta correspondencia entre estos dos métodos de toma de muestra para obtener los niveles de retinol y tocoferol, de los sujetos estudiados.
Los métodos tradicionales requieren de punción venosa, lo cual es un problema grande cuando se trata de neonatos, niños pequeños y grandes poblaciones de estudio, adicionalmente a esto, la cuantificación y el almacenamiento inmediato en congelación de las muestras, lo vuelve impráctico y costoso, sobre todo en países subdesarrollados.
En 1993 OlIiver et al, (15) reportaron con éxito el uso de muestras de suero sobre papel filtro para el análisis de retinol por HPLC, sin embargo, este método tuvo limitaciones ya que se requería de una cantidad alta de muestra (200mL), además de que este autor no probó la toma de muestra de sangre completa. Cuando Shi et al, (13) demostraron, en 1995, la posibilidad de medir retinol en GSS, se vio que este sistema abría la posibilidad de medir confiablemente esta vitamina. Posteriormente, en 1999, Craft et al, (9), comprobaron que en este sistema GSS se podía analizar retinol y que éste era comparable con el retinol sérico obtenido por punción venosa con una correlación de 0.90.
Sin embargo en todos estos estudios previos en GSS sólo se analizó retinol con diferentes opciones de cuantificación; en este trabajo se presenta la posibilidad de analizar conjuntamente retinol y tocoferol del sistema GSS, cuantificándolos por HPLC simultáneamente con una alta correlación con el suero obtenido por punción venosa, que es el patrón de referencia para estas mediciones.
CONCLUSIONES
Se pudo comprobar que el contenido de retinol y tocoferol en muestras de suero venoso, suero capilar y gotas de sangre saca capilar son iguales entre sí, lo que quiere decir que no hay ninguna diferencia significativa en cuanto a la cantidad de las vitaminas si se miden de cualquiera de las tres diferentes muestras.
Se concluye que el método propuesto para la cuantificación de estas vitaminas es una buena alternativa para eliminar los problemas presentados por los métodos tradicionales por punción venosa, con lo que se optimiza en gran medida la toma de muestra ya que no se requiere de personal entrenado ni de aparatos especiales para la toma de muestra y el almacenamiento que requiere de congelación inmediata, lo que disminuye importantemente su costo, sobre todo, cuando se trata de estudios poblacionales.
Los resultados obtenidos muestran que el sistema gota de sangre seca de sangre capilar (GSSC) es una buena alternativa para cuantificar retinol y tocoferol, ya que es comparable con las concentraciones séricas (SV).
REFERENCIAS
1.- L. Katbleen Maban, Sylvia Escote-Stump, Nutrición y Dietoterapia de Krause, Mc Graw Hill, 9ª edición, pp. 77-123, México, 1998.
2.- Mora, J. O., Herrera, MG Suecsun, J., Navarro, L., Wanger, M. “The effects of nutritional supplementation on physical growth of children at risk of malnutrition”, Am J. Clin Nutr., vol. 34, pp. 1885-1892, 1981.
3.- Pelletier, D. L., Frongillo, E, Habitch, J-P, “Epidemiologic evidence for a potentiating effect of on child mortality”. Am J Public Health, vol. 83, pp. 1130.1133, 1993.
4.- West K, P., Le clero., Shrestha, S. R., Wu, L. S-F, Pradhan, E. K., Khatry, S. K., Katz, J., Adhikari, R., Sommer, A. “Effects of vitamin A on growth of A-deficient children: Field Studies in Nepal”. J Nutr, vol. 127, pp. 1957-1965, 1997.
5.- Bauernfeind Christopher J, Vitamin A Deficiency and Its Control, Academic Press Inc, pp. 19-95, 1986.
6.- Susanne K. Gaby, Adrianne Bendich, Vishwa N. Sing, Lawrence J. Machlin, “Vitamin Intake and Health”, A Scientific Review, Marcel Dekker, Inc., pp. 71- 103, 1991.
7.- Encuesta Nacional de Nutrición 1999, Estado nutricional de niños y mujeres en México. Secretaria de Salud, Instituto Nacional de Salud Publica, Geografía e Informática.
8.- Underwood, B & Arthur, P., “The Contribution of Vitamin A to Public Health”,
FASE B J Nutr, vol. 130, pp. 882-885, 2000.
9.- Craft N.E., Haiteme, T., Brindle, L. K., Yamini, S. Humphrey, J.H., West, K.P., Jr., “Retinol Analysis in Dried Blood Sports by HPLC”. J Nutr., pp. 882-885, 2000.
10.-Craft, N.E., Bulux, J., Valdez, C., Li, Y., Solomons, N.W. “Retinol Concentrations in Capillary Dried Blood Sports From Healthy Volunteers: Method Validation”, Am J Clin Nutr, vol. 72, pp. 450-454, 2000.
11.-O´Broin, S. D., Gunter, E. W., “Screening of Folate Status with use of Dried Blood Spot son Filter Paper”, Am J Clin Nutr, vol. 70, pp. 359-356, 1999.
12.-Maldonado, J “Comparación del contenido de Flotato en Sangre Obtenidas Mediante dos diferentes Métodos de Muestreo”, Tesis, Licenciatura en Química, Universidad La Salle, 2000.
13.-Shi, Ma, Y., Humphrey, J.H., Craft, N.E. “Determination of Vitamin A in Dried Human Blood Spots By High-Performance Capillary Electrophoresis with laser- excited Fluorescence Detection”, J Chromatogr B Biomed Appl., vol. 665, pp. 89-96, 1995.
14.- Ma. Y. Wuu, Z. Furr, H.C., Lammi- Kreefe, C., Craft, N.E., “Fast Minimicroassay of Serum Retinal (vitamin A) by Capillary Zone Electrophoresis With Laser- Excited Fluorescence Detection”, J Cromatogr., vol. 616, pp. 31-37, 1993.