
Abordaje, diagnóstico y tratamiento
Oscar Vázquez Tsuji
Investigador y docente de la Facultad Mexicana de Medicina Universidad la Salle
Teresita Campos Rivera
Departamento de Parasitología y Micología Instituto Nacional de Pediatría
Adrián Rondán Zárate
Investigador y docente de la Facultad Mexicana de Medicina Universidad la Salle.
Recibido: Noviembre de 2005. Aceptado: Diciembre de 2005
RESUMEN
La Gnatostomiasis en México es causada por helmintos del género Gnathostoma. Durante mucho tiempo se pensó que esta enfermedad era rara y esporádica en México. La gnatostomiasis es una infección sistémica causada por la migración de larvas del nemátodo Gnathostoma. Esta parasitosis se considera como una zoonosis que involucra una gran variedad de animales que funcionan como huésped intermediario y definitivo del parásito. El consumo de pescado crudo es el factor de riesgo más importante.
Palabras claves: gnatostomiasis humana, infectología, parasitosis
ABSTRACT
Gnathostomiasis in Mexico is caused by Gnathostoma sp. For a long time this disease was considered rare and sporadic in Mexico. Gnatosthomiasis is a systemic infection caused by migrating nematode larvae of Gnathostoma. This parasitic disease is a zoonosis involving a wide variety of animals as intermediate and definitive hosts.
Consumption of raw fish is the main risk factor.
Key words: human gnathostomiasis, infectology, parasitosis disease
DEFINICIÓN
La gnatostomiasis es una zoonosis parasitaria causada por nemátodos del género Gnathostoma, el humano adquiere la infección al ingerir pescado crudo o mal cocido proveniente de agua dulce que se encuentre infectado con larvas de Gnathostoma tipo L3. Debido a que el humano es un huésped accidental el parásito no completa su ciclo biológico y sus larvas producen en el humano alteraciones cutáneas, oftalmológicas, neurológicas y viscerales (1,2).
SINONIMIAS
La forma cutánea se conoce también como edema migratorio eosinofílico, paniculitis nodular migratoria eosinofílica, paniculitis migratoria, paniculitis nodular eosinofílica o larva migrans por Gnathostoma (3).
En países asiáticos como China, Japón e India se conoce como edema de Quincke, Reumatismo de Shanghai, Enfermedad del Consulado de Nangching, edema del Nangching, edema de la rivera del Yang Tse o choko fushu, y en Tailandia se conoce como Tua-chid que significa tumor doloroso (3).
ANTECEDENTES HISTÓRICOS
La primera descripción del nematodo fue hecha por Sir Richard Owen en 1836 en Londres, Inglaterra, al realizar la autopsia de un tigre, creó el género Gnathostoma y lo denominó como Gnathostoma spinigerum (4).
En 1872, Fedchenko identificó en el estómago de un cerdo silvestre y en el de un cerdo doméstico; el primero proveniente de Turquía y el segundo de Hungría al parásito adulto al cual describió como G. hispidium (5).
En humanos la primera descripción la realizó Levinsen, en 1889, en una mujer tailandesa. En 1902, en japoneses residentes en China, se describió una enfermedad denominada edemas del Yang Tse o choko fushu. Tubangui, en Filipinas en 1925, describió al parásito adulto hembra de Gnathostoma doloresi en el estómago de un cerdo y, en 1930, Malpestone hizo la descripción de un parásito adulto macho también en el estómago de un cerdo proveniente de la India (6).
En los años de 1933 a 1937 Prommas y Daengsvang dilucidaron el ciclo de vida de Gnathostoma. Miyazaki, entre 1951 y 1953, encontró parásitos de G. doloresi en jabalíes. En 1984, Ollague-Loaiza la designaron como paniculitis nodular migratoria eosinofílica y reportaron los primeros casos en Ecuador (3).
Entre los años de 1988 y 1989 Nawa y cols, y Ogata y cols, describieron los primeros casos humanos causados por G. doloresi. Posteriormente se han seguido reportando casos que se han relacionado con el consumo de algunas especies de peces así como con el consumo de serpientes del género Agkistrodon halyz (5).
Parásitos adultos de G. niponicum se han aislado del esófago de comadrejas, correspondiendo a Yamaguti la descripción morfológica. Sin embargo, se desconoce su ciclo biológico. Los primeros casos humanos debidos a esta especie se reportaron entre 1988 y 1991 por Ando y cols. (2).
En México, Caballero identificó por primera vez, en 1958, al nematodo adulto en tlacuaches en Jaltenango, Chiapas. Los dos primeros casos de enfermedad en México y en América reportados en humanos corresponden a Peláez y Pérez Reyes, en 1970, en dos personas de Sinaloa. Posteriormente, en 1986, fue identificado el primer foco endémico en México por Martínez Cruz, correspondiendo a las inmediaciones de la cuenca del río Papaloapan; en 1989, él mismo reportó nuevos casos de gnatostomiasis en humanos (1).
AGENTE ETIOLÓGICO
El agente etiológico es un nemátodo del género Gnathostoma, se han involucrado como causantes de la enfermedad: G. spinigerum, G. doloresi, G. binucleatum, G. hispidium y
G. nipponicum. El parásito se encuentra incluido dentro de la superfamilia Spiruroidea (2). Véase Cuadro 1.
Superfamilia: Spiruroidea (Raillet y Henry 1915)
Familia: Gnathostomatidae (Raillet 1895)
Subfamilia: Gnathostominae (Baylis y Lane 1928)
Género: Gnathostoma (Owen 1836)
MORFOLOGÍA DEL PARÁSITO
El adulto macho Gnathostoma spinigerum mide de 16 a 40 mm de largo por 1 a 3 mm de ancho, la hembra mide entre 13 a 55 mm de diámetro. Ambos tienen cuerpos cilíndricos, el extremo anterior se encuentra formado por un bulbo cefálico, con 7 a 9 hileras transversas de ganchos y con 20 a 131 ganchos en cada hilera. La mitad anterior a las dos terceras partes del cuerpo se encuentra cubierto con numerosas filas de espinas que gradualmente disminuyen en densidad y tamaño hacia el extremo posterior hasta ser apenas perceptibles o estar ausentes. Las espinas cuticulares varían en tamaño y forma dependiendo de su localización en el cuerpo. Miden 62 mm de longitud. La cutícula tiene 5 a 10 mm de grosor y estrías transversales. El esófago se compone de una porción muscular anterior y una larga poción glandular posterior. Las células intestinales están cubiertas por microvellosidades prominentes. Contienen pigmentos glandulares y tienen de 2 a 8 núcleos. Los adultos de ambos sexos tienen dos pares de sacos cervicales en la porción anterior. Los machos adultos tienen un solo testículo y 2 espículas copulatorias y un para de papilas. Las hembras adultas tienen un par de ovarios y una vulva en la mitad posterior del cuerpo (2-7).
Los huevos de G. spinigerum no están embrionados cuando son expulsados con la materia fecal de los huéspedes definitivos. Tienen forma oval, presentan un tapón mucoso en un extremo y miden 56 x 79 mm de largo por 34 a 43 mm de ancho (4).
Las larvas de tercer estadio avanzado de G. spinigerum son pequeñas miden de 3 a 4 mm de largo por 630 mm de grueso y sólo tienen 4 hileras transversas de ganchos cefálicos, con un promedio de 42 a 49 ganchos por hilera. El cuerpo de la larva esta cubierto con más de 200 hileras transversas de pequeñas y sencillas espinas que disminuyen en tamaño y densidad hacia el extremo posterior (7). Véase Figura 1.

Figura 1 . Larva de tercer estadio de Gnathostoma spinigerum. Nótese la presencia de hileras de ganchos cefálicos. Microscopía de campo claro. 10X
Foto cortesía Dr. Manuel Gutiérrez Quiroz .
CICLO BIOLÓGICO
El ciclo biológico de Gnathostoma involucra diferentes huéspedes definitivos, intermediarios y paraténicos. Entre los huéspedes definitivos se encuentran perros, gatos, cerdos, felinos silvestres, tlacuaches, mapaches, nutrias. Los huéspedes intermediarios corresponden a diversas especies de crustáceos y peces de agua dulce y entre los paraténicos se encuentran algunas especies de aves ictiófagas, anfibios y reptiles.
El ciclo biológico inicia cuando el huésped definitivo expulsa los huevos del parásito junto con la materia fecal, que al ser depositada en agua de lagos, ríos o presas con temperatura que varía de 24 a 28°C, los huevos fértiles pasan por un proceso de embriogénesis que da por resultado la formación de una larva de primer estadio (L1), en un lapso relativamente corto se lleva a cabo la primera ecdisis o muda que da origen a una larva rhabditoide de segundo estadio (L2) que eclosiona del huevo a través del opérculo para desplazarse libremente en el agua.(2,4,7) El proceso dura aproximadamente 7 días. Posteriormente la larva es ingerida por pequeños crustáceos (copépodos) de los géneros Cyclops, Acantocyclops, Mesocyclops, Ancyracanthocyclops, Eucyclops, Tropocyclops sp., que corresponden a los huéspedes intermediarios primarios. En el tubo digestivo del crustáceo la larva L2 pierde la vaina y emigra hacia el hemocele donde muda a larva de tercer estadio temprana (L3T), período que dura aproximadamente de 7 a 10 días.
Los copépodos sirven de alimento a los segundos huéspedes intermediarios peces de agua salada o dulce. En el estómago de estos huéspedes la larva L3T atraviesa la pared gástrica o intestinal y migra hacia las masas musculares donde adquiere la forma de larva de tercer estadio avanzada (L3A). Esta etapa que tiene aproximadamente 1 mes de duración. La larva muda cuando los peces infectados son depredados por los huéspedes definitivos y se transforma en larva de cuarto estadio (L4), sufriendo una nueva muda para convertirse en gusano adulto y alojarse en su hábitat definitivo: las criptas del esófago o en la pared del estómago en cavidades formadas por células hiperplásicas infiltradas por un exudado inflamatorio, donde alcanza la madurez sexual, realiza la cópula y la hembra inicia la postura de huevos.(7)
Al ser depredados, los peces infectados con la larva L3A, por animales que no son los huéspedes definitivos habituales, los parásitos no alcanzan la etapa adulta, desarrollando el fenómeno conocido como paraténesis (1,2).
La larva L3A que se encuentra en los peces infectados, generalmente es la forma infectante para el hombre, cuando ingiere peces infectados con larva L3A, ya sea en la forma de cebiche, sushi o sashimi se convierte en huésped accidental completándose así la zoonosis (1).
En México, la especie que más se ha relacionado con la gnatostomiasis humana es
G. spinigerum, y los peces que se han identificado como fuente de infección para el humano son: mojarra tilapa (Oreochromis spp.), mojarra tenguayaca (Petenia splendida), chucumite (Centropomus parallelus), cuatete (Cathorops spp y Ariopsis spp), guavina (Gobiomorus dormitor) popoyote (Dormitator latifrons) (7).
La cronicidad de las manifestaciones clínicas se puede explicar por la larga sobrevida que puede llegar a tener la larva que es de hasta 16 años. Cabe mencionar que la larva muere a los 5 minutos de cocción de la carne al hervirla, en vinagre sobrevive 5 horas y en limón logra sobrevivir hasta durante 24 horas (4).
EPIDEMIOLOGÍA
La gnatostomiasis es una zoonosis parasitaria endémica en el Sureste de Asia, los países más afectados son Tailandia y Japón. También se han descrito casos en Singapur, China, India, Indochina, Indonesia, Vietnam, Filipinas y Java, así como en Australia. En América se han reportado casos en México, Ecuador, Brasil y Argentina. En Estados Unidos se han reportado casos en inmigrantes asiáticos. En Europa también se han reportado casos que son exportados de zonas endémicas como consecuencia de vacacionistas que acuden a estas áreas de alta endemia (6).
En nuestro país la enfermedad es considerada como relativamente nueva. Se han identificado casos en estados como Sinaloa, Nayarit, Jalisco, Guerrero, Oaxaca, Tamaulipas, Veracruz, Distrito Federal, Tabasco y Baja California Norte. Las principales zonas endémicas son: La presa Miguel Alemán Valdés en Temascal, Oaxaca; el río Papaloapan en Cosamaloapan, Veracruz; la presa Adolfo López Mateos en el Varejonal en Culiacán, Sinaloa; el río Pánuco en Tampico, Tamaulipas; y, en Río Grande de Santiago en Tepic, Nayarit (5,7).
Son múltiples los reportes de casos diagnosticados de gnatostomiasis en México por diferentes autores como Barcelata, quien en 1988 informó del caso de un niño de 7 años oriundo de Tierra Blanca, Veracruz, que presentó gantostomiasis en el ojo izquierdo. Vázquez Maya y Espinoza reportaron, en 1993, otro caso ocular en el ojo izquierdo, procedente de Uspanapa, Veracruz. En este mismo año Funata y cols, en Estados Unidos, reportaron un caso también de localización ocular de una mujer que estuvo de vacaciones en Acapulco. Para 1996, Messina-Robles, en el XII Congreso Nacional de Parasitología efectuado en Aguascalientes, Ags, reportó 656 casos en Tepic, Nayarit. En el año 2001, Magaña y Messina Robles reportaron 934 casos más.
En el estado de Nayarit se han ido incrementando los casos, dato que se confirma con los reportes que tiene la Secretaría de Salud, que para 1998 registró más de 1,000 casos en todo el estado; en 1999 registró 1,090 casos, para el año 2000 registró 1,453 casos y hasta junio de 2001 tenía registrados 465 casos más. Es conveniente comentar que no todos han sido confirmados mediante estudios inmunológicos o histológicos. No así, en el estado de Sinaloa en donde, desde 1991, la mayoría de los casos registrados han tenido confirmación inmunológica mediante el antígeno de Gnathostoma doloresi. En 1996 Martínez Cruz informó de 440 casos en la cuenca del río Papaloapan. Rojas y cols, en Acapulco, Guerrero desde 1991 han reportado más de 100 casos (2,5,7).
En el trabajo realizado por Ogata y cols, estimaron que en México, hasta 1996, se habían registrado 1,380 casos, de los que sólo algunos tuvieron confirmación inmunológica mediante antígenos de G. doloresi, G. spinigerum y G. hispidium, siendo casos provenientes de Temascal y Culiacán. En la mayoría el diagnóstico se hizo clínicamente. Actualmente se siguen reportando casos aislados en Tabasco, Hidalgo, Jalisco y Aguascalientes (6).
Asimismo, en los estados de Yucatán, Michoacán, Morelos, Colima y Chiapas se han identificado los parásitos adultos o larvas de Gnathostoma en animales domésticos y silvestres. En 1990, Ortiz y Villaseñor reportaron el primer caso de G. procyonis en el estómago de tlacuaches procedentes de Tepoztlán, Morelos. En 1991, Almeida describió una nueva especie que denominó G binucleatum en felinos silvestres provenientes de la cuenca del río Papaloapan, en Oaxaca-Veracruz. Además, identificó a G. turgidum en un tlacuache que provenía de esa misma zona (4).
Hacia el año 2001 se calculaba que había aproximadamente otros 8,000 casos registrados, por lo que se considera a la gnatostomiasis como un verdadero problema de salud pública en México, aunque realmente la casuística real se desconoce (5).
MECANISMOS DE PATOGENICIDAD
Cuando el hombre ingiere pescado crudo o insuficientemente cocido con la larva L3A de Gnathostoma, ésta se libera en el estómago, perfora la pared gástrica para alcanzar el hígado y de aquí puede dirigirse a cualquier sitio de la economía, siendo la piel del tórax y el abdomen los sitios más frecuentemente afectados (1,2).
Los mecanismos patogénicos de Gnathostoma aún son desconocidos. Sin embargo, se ha involucrado en la patogenia el efecto mecánico producido por la migración del parásito en el tejido, la eliminación se sustancias tóxicas similares a la acetilcolina, la producción de enzimas proteolíticas como la hialuronidasa y de una sustancia hemolítica, además de la respuesta inflamatoria debida a la reacción inmunológica del huésped (2,4).
En la piel las alteraciones iniciales se presentan durante los primeros días después de la infección. Se caracterizan por un infiltrado perivascular superficial y profundo con presencia de linfocitos y escasos eosinófilos; posteriormente, éstos se incrementan alrededor de los adipocitos y de los septos interlobulares, con zonas de hemorragia. En el panículo adiposo se observa un gran infiltrado inflamatorio con predominio de eosinófilos; los linfocitos son escasos y existen grandes zonas con hemorragia. Esta imagen se identifica como paniculitis nodular migratoria eosinofílica, misma que se puede presentar en otras parasitosis. Motivo por el que algunos autores no la aceptan como signo patognomónico de larva migrans por Gnathostoma (1-5).
Durante su migración por los tejidos del huésped Gnathostoma induce una respuesta inmune humoral y celular tipo Th2, con liberación de interleucinas (IL-3, IL-4, IL-5, IL-6, IL-10, IL-13), así como del factor de estimulador de colonias granulocíticas y monocíticas (GM-CSF), que induce producción de IgE por las células plasmáticas, generando la producción de eosinófilos y su maduración (3,4).
CUADRO CLÍNICO
La sintomatología inicial corresponde a la migración de la larva al hígado, se presenta entre el 1° y 2° día después de haber ingerido pescado crudo infectado o bien carne infectada insuficientemente cocida proveniente de hospederos paraténicos. Se caracteriza por la presencia de dolor gástrico localizado en el hipocondrio derecho, sialorrea, náusea, vómito, urticaria y fiebre; leucocitosis leve y aumento acentuado de eosinófilos. Posteriormente la sintomatología dependerá del sitio del organismo que invada la larva. Dependiendo de la localización de la larva las manifestaciones clínicas se clasifican en cutáneas, oculares, viscerales y neurológicas (2).
Gnatostomiasis cutánea.
Las manifestaciones cutáneas se clasifican en cuatro variedades: Inflamatoria, serpiginosa, pseudofurunculosa y mixta.
a) Inflamatoria o profunda. También conocida como edema migratorio eosinofílico o paniculitis nodular migratoria eosinofílica, se caracteriza por la presencia de edemas migratorios intermitentes de aspecto eritematoso, indurados con aumento de la temperatura local y prurito intenso, miden de 1 a 10 cm de diámetro, no depresible a la palpación y de bordes difusos. A pesar de su aspecto la lesión no es dolorosa. En cambio, en lugar de evolucionar hacia la supuración, necrosis o curación, la lesión empieza a desplazarse caprichosamente de 1 a 5 cm diarios. Después de un período variable (de unas horas hasta 30 días) su intensidad disminuye. Posterior a la desaparición del edema queda una zona hemorrágica que desaparece en un lapso de dos a cinco semanas; sólo para volver a presentarse con las mismas características en el mismo sitio, o en una región vecina o distante después de un período latente de semanas, meses y en ocasiones de más de un año. Esta persistencia en la recaída es muy característica de la enfermedad y puede repetirse durante años. La lesión puede aparecer en cualquier parte del cuerpo, aunque el primer brote es más frecuente en el tórax.
En esta helmintiasis no se presenta ataque al estado general, el paciente se encuentra afebril, conserva la actividad y el apetito y sólo ocasionalmente presenta un discreto malestar. Por lo anterior, es entendible que el paciente no le de importancia al padecimiento y no acuda al médico. Otras personas refieren que tienen la sensación de que algo les “camina” bajo la piel, situación que les preocupa y es el principal motivo por el que acuden a recibir atención médica (2-4).
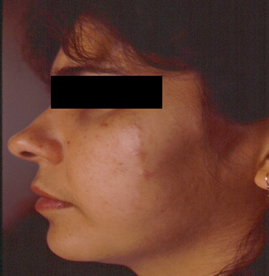
b) Serpiginosa o superficial. En esta presentación y debido al desplazamiento de la larva en el tejido subcutáneo, no induce la reacción inflamatoria descrita anteriormente, sino que simplemente se presentan surcos poco sinuosos, que en el extremo por donde avanza la larva el surco es más ancho, eritematoso y pruriginoso. Las lesiones son semejantes a las que producen en el hombre las uncinarias de los perros y de los gatos Ancylostoma caninum y Ancylostoma braziliensis o las larvas de Strongyloides stercoralis, pero las lesiones producidas por Gnathostoma no son tan sinuosas, sino más anchas y rectas. Las lesiones desaparecen en un lapso de aproximadamente dos a cinco semanas. En nuestro país esta forma clínica es menos frecuente que la variedad inflamatoria (2-4 ). Véase Figura 2.
Figura 2. Gnatostomiasis serpiginosa localizada a región maxilar izquierda. Nótese la presencia de una lesión eritematosa de aspecto serpiginoso elevada ancha. Foto.
Cortesía M en C. Aurora Candil Ruíz.
c) Pseudofurunculosa. Es una presentación poco frecuente en nuestro medio. Podríamos mencionar los casos presentados en Oaxaca y Veracruz. La lesión se presenta como una pápula roja e indurada que rápidamente se hace más pequeña y superficial; en ocasiones la lesión puede presentar en el centro un color pardo o
Rev. del Centro de Inv. (Méx.) Vol. 7. Núm. 25. Ene..- Jun. 2006 71
negruzco que termina por abrirse en la superficie de la piel. Con la salida del parásito se origina, por consiguiente, la curación del paciente, y al mismo tiempo se logra hacer el diagnóstico etiológico del padecimiento (2-4).
d) Mixta. Esta variedad se puede desarrollar en pacientes que quizá están invadidos por más de una larva y, por lo tanto, presentan más de una forma cutánea (2-4).
Gnatostomiasis Ocular.
En México el primer caso de gnatostomiasis ocular fue descrito en 1970 por Peláez y Pérez Reyes en un paciente de Culiacán Sinaloa, en el que la larva fue extirpada del ojo izquierdo y se identificó como una larva de Gnathostoma de aspecto muy semejante a la larva de G. Spinigerum. A partir de esta fecha se han descrito más de 5 casos de gnatostomiasis ocular en la literatura nacional (6).
De acuerdo con una revisión realizada por Lamothe y cols, de los casos oculares que se han reportado en México, curiosamente, todos han presentado afección en el ojo izquierdo. Clínicamente se caracterizaron por dolor ocular intenso, disminución súbita de la agudeza visual, conjuntivitis, panuveitis, hemorragia en la cámara anterior e hipertensión ocular secundaria. A la exploración oftalmológica se detectó material mucoide, hiperemia conjuntival mixta, córnea edematosa con estrías en “descement” iris irregular, con algunas zonas de atrofia (5,6).
La sintomatología ocular depende del tiempo de evolución y localización de la larva, desde la disminución de la agudeza visual hasta el desprendimiento de la retina. El cuadro clínico se inicia generalmente con edema palpebral y celulitis orbitaria. Al penetrar en el globo ocular la larva ocasiona intenso dolor del globo ocular, en forma súbita se presenta disminución de la agudeza visual, edema localizado de la retina o área macular, hemorragia retiniana, iritis, uveitis, vitreitis, celulitis orbital. Posteriormente se presenta edema de la córnea (6).
Las larvas de Gnathostoma obtenidas mediante cirugía ocular se describen de color rojizo en la parte externa y en la interna de color oscuro, de forma cilíndrica y extremos redondeados, con una longitud de 2 mm y 0.225 mm de diámetro; en su extremo anterior presenta un bulbo cefálico espinoso con dos labios, cada uno con un par de papilas en medio de las cuales se abre la boca; el bulbo cefálico se encuentra separado del cuerpo por una ligera estrangulación y presenta cuatro hileras de ganchos quitinosos, cuyo número forma y disposición tienen importancia taxonómica. El cuerpo presenta numerosas hileras transversales de espinas cuticulares que se van haciendo cada vez más escasas conforme se acercan al extremo posterior (2,6).
El bulbo cefálico presenta en su interior dos pares de estructuras huecas llamadas ballonetas que comunican cada una con un saco cervical, probablemente funcionan como un mecanismo hidráulico en los movimientos de expansión y retracción del bulbo (2,6,7).
La boca comunica con una faringe en forma de clava que ocupa el primer tercio del cuerpo, se continua con el intestino y termina en el ano el que se encuentra situado en la parte ventral y subterminal del extremo posterior (2).
Gnatostomiasis cerebral
La gnatostomiasis en sistema nervioso central es una infección rara. Se presenta como un cuadro de meningitis eosinofílica y se caracteriza por cefalea intensa, pérdida transitoria de los reflejos osteotendinosos en miembros inferiores, paraplejia, retención de orina, con la alteración de los pares craneales con parálisis facial, dificultad para deglutir, nistagmo, disartria, confusión mental, parálisis de las extremidades, pérdida repentina de la conciencia como consecuencia de hidrocefalia obstructiva transitoria o de hemorragia cerebral, coma y muerte. En la hemorragia subaracnoidea la mortalidad es de entre el 8 y el 25% (2-7).
En una serie de 24 pacientes estudiados por Boongird y cols, en Tailandia, encontraron entre otras alteraciones cefalea intensa, radiculomielitis, hemorragias subaracnoideas, radiculomieloencefalitis, alteración de pares craneales, deficiencias motoras y sensitivas de las extremidades, estado de coma. De los 24 pacientes 6 murieron. En México no se tienen reportes de esta localización (6).
Gnatostomiasis visceral
Durante su migración la larva L3A puede afectar el aparato gastrointestinal. El paciente puede cursar asintomático y ser un hallazgo al realizar alguna cirugía por otra causa, o bien semejar un cuadro de apendicitis, obstrucción intestinal o carcinoma de colon. El cuadro clínico se manifiesta por la presencia de una tumoración dolorosa de crecimiento lento localizada al cuadrante inferior derecho, acompañada de dolor agudo en cuadrante inferior derecho. Al migrar la larva a través del hígado se presenta dolor abdominal en cuadrante superior derecho; por la cercanía de estructuras puede penetrar diafragma y ocasionar sintomatología pleuropulmonar con presencia de tos, disnea, hemoptisis, dolor pleurítico, consolidación lobar, derrame pleural o pneumotórax. Ocasionalmente la larva llega a ser expulsada con la expectoración resolviéndose el cuadro (2-4).
En el aparato genitourinario en la mujer se manifiesta con dolor urente suprapúbico, inflamación perineal, tumoración de los anexos, fiebre, sangrado transvaginal, cervicitis; en el hombre produce balanitis. Cuando se localiza en el tracto urinario se presenta hematuria. La larva puede expulsarse a través de la orina o bien por la vagina y presentarse la curación (2-4).
Gnatostomiasis oral
También se ha identificado a Gnathostoma en cavidad oral en encías, glándulas salivales y en dientes. Puede salir a través de la lengua. En la localización en oído se presenta disminución de la agudeza auditiva, tinitus, pudiéndose eliminar la larva a través del conducto auditivo externo (2-4).
DIAGNÓSTICO DIFERENCIAL
Se deberá hacer diagnóstico diferencial de la gnatostomiais; se deberá hacer con Infecciones causadas por Ancylostoma duodenale o por Necator americanus, paragonimiasis, fasciolosis ectópica, o larva migrans visceral (toxocariasis visceral).
DIAGNÓSTICO
El diagnóstico definitivo se hace con la demostración de la larva L3A de Gnathostoma, situación que no siempre puede realizarse, por lo que en el establecimiento del diagnóstico deben tenerse en cuenta los aspectos epidemiológicos son: la ingesta de carne de pescado crudo a mal cocido, el lugar de residencia del paciente principalmente si procede de áreas donde la gnatostomiasis es endémica, o haber viajado recientemente a esas zonas, así como el antecedente de haber presentado edema subcutáneo migratorio y eosinofilia en sangre periférica (2).
La serología es de utilidad en el diagnóstico de la Gnathostomiasis. Así, se han utilizado diferentes técnicas serológicas como la inmunoflurescencia indirecta, la hemaglutinación indirecta, el ELISA o la inmunoelectrotransferencia. Los antígenos utilizado han sido extractos crudos de larvas L3A de G spinigerum y adultos de G. Dolore si. Actualmente la prueba que más se utiliza es el ELISA utilizando antígenos de un extracto somático crudo y uno de excreciones y secreciones, que tiene una sensibilidad del 93% y una especificidad de 98.7%. En la prueba de inmunoblot realizada en paciente positivos se obtienen 2 bandas fuertes (30 y 38 kDa) y dos bandas débiles (35 y 43 kDa). La detección de IgE circulante es significativamente positiva al encontrarse bastante elevada. La biometría hemática reporta leucocitosis y eosinofilia de hasta el 31%, en el 50 al 70% de los pacientes (2,4,6).
Histológicamente se observa una paniculitis eosinofílica caracterizada por la presencia de infiltrados de mononucleares y eosinófilos. Se afectan los septos y el lobulillo sin producir necrosis (Pani eosino).
El líquido cefalorraquídeo se observa hemorrágico, xantocrómico, con aumento de las células de la serie blanca con predominio de linfocitos y un número variable de eosinófilos. Las proteínas se encuentran ligeramente elevadas, la glucosa se reporta normal (6).
TRATAMIENTO
Es importante mencionar que no existe tratamiento específico para esta helmintiasis. El más eficiente es la extirpación quirúrgica de la larva, procedimiento que no siempre es posible realizar. Con el tratamiento antiparásito es importante tener en cuenta que la recurrencia de la gnathostomiasis puede ser hasta de más de un año.
En relación con los medicamentos se han utilizado diferentes antiparasitarios como el albendazol que inicialmente fue probado en ratas y gatos infectados con L3T, observándose muerte de la larva pero sólo en algunos casos. Con este antecedente Kraivichian y cols, realizaron un estudio antiparasitario en 112 pacientes que presentaban gnatostomiasis cutánea sintomática, con dos esquemas diferentes. Uno con albendazol a dosis de 400 mg por día durante 21 días, y el otro a igual dosis pero repartida en dos tomas durante el mismo período, los siguieron durante 6 meses al cabo de este periodo, los casos asintomáticos fueron considerados curados. La eficacia del tratamiento fue reportada entre el 93 y el 94% (8).
En México, en el estado de Sinaloa han sido tratados pacientes con albendazol a dosis de 10 mg/kg/día durante 20 días (dosis máxima 1000 mg), observando que las larvas emergen a planos superficiales de la piel entre los días 10 y 14 del postratamiento, con la formación de una lesión pseudofurunculosa en donde se puede realizar una escisión para extraer el parásito. En 20 pacientes que recibieron este tratamiento se realizaron biopsias cutáneas recuperándose sólo 7 larvas viables, en los 13 casos restantes se encontraron las larvas necrosadas. Con lo anterior se demuestra que al menos hasta los 14 días de tratamiento el antiparasitario no destruye el parásito (9,10).
Actualmente se está utilizando la ivermectina, medicamento que según reportes tiene una eficacia del 100% con una sola dosis de tratamiento (9,10).
La ivermectina administrada por vía oral se absorbe rápidamente, las concentraciones terapéuticas se alcanzan 4 horas después de su ingestión. Por vía tópica la absorción también es adecuada, su acción terapéutica se alcanza a las dos horas cuando se aplica sobre la piel intacta y en minutos en los casos de miasis cutánea. La ivermectina es excretada junto con la materia fecal en el más del 99% y sólo menos del 1% se excreta por vía renal (9-11).
Una dosis oral de 200 microgramos/kg (mg/kg) tiene una toxicidad insignificante. Los tratamientos repetidos han sido tolerados adecuadamente. A dosis de 10 mg/kg produce ataxia, bradipnea, ptosis palpebral, disminución de la actividad corporal, temblores, náusea, vómito y midriasis (11).
Como efectos adversos se pueden observar la presencia de incremento del prurito en el sitio de la infestación, en filariasis produce fiebre, adenopatías y artralgias, alteraciones de las que no se ha determinado su origen, puesto que se ignora si su aparición se debe a la destrucción de los parásitos o a efectos secundarios del medicamento. En animales de experimentación la administración de una dosis hasta 10 veces mayor de la recomendada produce náusea, vómito, somnolencia, letargo, convulsiones, coma y muerte. En humanos no se ha presentado ninguna defunción atribuida a su administración (9-11).
En los microsomas hepáticos la ivermectina es metabolizada, con la formación de al menos 10 metabolitos, la mayoría son hidrolizados y demetilados. Se ha demostrado que el citcromo P4503A4 es el responsable del metabolismo de la ivermectina. Este citocromo es diferente del P450, citocromo que se le ha atribuido ser productor de la hepatoxicidad.
Por la seguridad de que brinda la ivermectina se recomienda en pacientes con SIDA, inmunocomprometidos o sujetos a corticoterapia.
La ivermectina presenta un mecanismo de acción basado en la unión a los canales glutamados del calcio del ácido para amino butírico presente de las neuronas y tejido muscular de los invertebrados, al inhibir su función produce la muerte de los parásitos por asfixia e inanición. La ivermectina no tiene efectos sobre la acetilcolina, norepinefrina y serotonina del huésped, por lo que no interfiere su función (9-11).
La FDA en 1996 aprobó la ivermectina para uso humano en tabletas de 6 mg, indicada especialmente para la oncocercosis y la estrongiloidosis en niños mayores de 5 años de edad. Francia, en 2001, aprobó su uso en personas con escabiasis. Sin embargo, en algunos países en desarrollo aún no ha sido aprobada en parasitosis como pediculosis (capitis, corporis y pubis), escabiasis, miasis, larva migrans cutánea, tunguiasis, toxocariasis, gnatostomiasis y cisticercosis. Su uso está contraindicado en menores de 5 años, en mujeres embarazadas o en estado de lactancia (11-16).
En México, se ha usado la ivermectina a dosis de 200 microgramos/kg en niños con escabiasis y larva migrans cutánea. En ninguno se presentaron efectos secundarios (14).
En resumen, la ivermectina es un medicamento seguro, de fácil aplicación, eficaz y barato, con mínimos efectos secundarios que puede administrarse en niños a partir de un año de edad que presenten ecto y endoparasitosis (9-16).
REFERENCIAS
1. Cruz Aubry JE. “Zoonosis en la República Mexicana”. Rev Endocrinología y Nutrición, vol. 4, pp. 206-208, 2002.
2. Díaz-Camacho SP, de la Cruz Otero MC, Willms MK. “Gnathostomosis”. Rev Fac Med UNAM, vol. 5, pp. 192-201, 2000.
3. Ferrer-Bernat J. “Paniculitis eosinofílica migratoria subaguda”. Dermatología Rev Méx., vol. 1, pp. 19-23, 1991.
4. Martínez-Cruz JM, Bravo-Zamudio R, Aranda-Petrarca A, Martínez-Marañón R. “La Gnatostomiasis en México”. Salud Pública Méx., vol. 31, pp. 541-549, 1989.
Rev. del Centro de Inv. (Méx.) Vol. 7. Núm. 25. Ene..- Jun. 2006 75
5. Lamothe-Argumedo R. “La Gnatostomiasis en México: un problema de salud pública”. Anales del Instituto de Biología. U.N.A.M. Serie Zoología, vol. 1, pp. 99- 103, 2003.
6. Wong-Ortíz F, López JS, Ble-Castillo JL. “Gnatostomiasis ocular. Registro del primer caso para el estado de Tabasco”, vol. 5, pp. 180-184, México, 2001.
7. Cruz-Reyes A, Botey MA. “Larva Migrans en México y su etiología por
Gnathostoma sp.”, Mundo Médico, vol. 28, pp. 11-22, 1997.
8. Kraivichian P., Kulkumthorn M., Yingyourd P., Akarabovorn P., Paireepai CC. “Albendazol for the treatment of human gnathostomiasis”. Trans R Soc Trop Med Hyg., vol. 86, pp. 418-421, 1992.
9. Victoria J. “Usos clínicos de la ivermectina: estado actual de su uso en humanos”. Rev Col Dermatol., vol. 7, pp. 11-15, 1999.
10. Victoria J. “Ivermectina: nuevos usos de una vieja droga”. Rev Col Dermatol., vol. 7, pp. 29-32, 1999.
11. Del Mar Saez-De-Ocariz M, McKinster CD, Orozco-Covarrubias L, Tamayo- Sanchez L, Ruiz-Maldonado R. “Treatment of 18 Children with or Cutaneous Larvae Migrans Using Ivermectin”. Clin Exp Dermatol., vol. 27, pp. 264-7, 2002.
12. Elmogy M, Fayed H, Marzok H, Rashad A. “Oral Ivermectin in the Treatment of Scabies”. Int J Dermatol., vol. 38, pp. 926-930, 1999.
13. Huffam SE, Currie BI. “Ivermectin for Sarcoptes Scabiei Hyperinfestation”. Int J Dis., vol. 2, pp. 152-154, 1998.
14. Yeruham I, Hadani A. “Control of Human Scabies by Tropical Application of Ivermectin”. Ann Trop Med Parasitol., vol. 92, pp. 627-629, 1998.
15. Brooks PA, Grace RF. “Ivermectin is Better than Benzyl Benzoate for Childhood Scabies in Developing Countries”. J Paedriatr Child Health, vol. 38, pp. 401-4, 2002.
16. VictoriaJ, “Uso de ivermectina en niños”. Dermatol Pediatr Lat., vol. 1, pp. 61-65, 2003.