
Ana Lidia Vargas-Rodríguez
Escuela de Ciencias Químicas de la Universidad La Salle
E-mail: aglae_ivanova@yahoo.es Asesores:
Eva Ramón-Gallegos Ma. Luisa Vega-Barrita
Departamento de Morfología
E-mail: evaramong@portugalmail.pt
Alfredo Cruz-Orea
Departamento de Física. CINVESTAV-IPN
Roxana Olvera-Ramírez
Escuela de Ciencias Químicas de la Universidad La Salle
Recibido : Agosto de 2005. Aceptado: Octubre de 2005
RESUMEN
Las ficobiliproteínas (PBs) son los principales pigmentos accesorios de las algas rojas y de algunas cianobacterias. Tienen valor terapéutico como inmunomodulador, sin embargo en el tratamiento del cáncer su uso es escaso.
Las PBs son proteínas que tienen unidos a sus residuos de cisteína, grupos prostético tetrapirroles lineales. Estos grupos tienen dobles enlaces conjugados que permiten la transferencia de electrones, con lo cual podrían emplearse como fotosensibilizadores en la Terapia Fotodinámica (PDT).
Debido a que en México el cáncer cervicouterino es un problema serio de salud pública, es necesario encontrar opciones para abatir los costos y permitir la aplicación de diferentes terapias. Así, el objetivo de este trabajo fue comparar la respuesta de dos líneas celulares de cáncer cervicouterino (CaLo y HeLa) a las mismas concentraciones de PBs, manejando dos posibles tratamientos, en el primero únicamente exponiéndolas a las PBs y el otro con exposición simultanea a la irradiación con un láser de argón.
Se realizó una extracción de PBs a partir de un gramo de biomasa de Pseudoanabaena, en buffer de fosfatos. La caracterización se realizó mediante la lectura de la absorbancia de la muestra a 565, 620 y 650 nm para determinar las concentraciones de PBs. Para determinar la efectividad de las PBs en la PDT, se sembraron 5x104 células HeLa y CaLo por pozo en microplacas de 96 pozos. Las células se expusieron a las siguientes dosis de PE: 2.17x10-3, 4.35x10-3, 8.70x10-3, 8.7x10-3, 3.48x10-2, 6.96x10-2 mg/ml. Después de 3h de exposición se irradiaron con un láser de argón a 127 J/cm2. Pasadas 24 h se determinó la viabilidad celular por el método del rojo neutro tanto en las células irradiadas como en las no irradiadas. Se determinó que para Hela las dos primeras dosis eran seguras, sin embargo cuando las células se irradiaron se determinó 46% de muerte celular en ambas dosis. En las dosis más altas la muerte celular fue del 48 al 57%. Sin embargo en CaLo no se observó diferencia significativa entre ambos tratamientos, mostrando una alta mortalidad indistintamente. Por lo que podemos concluir que el extracto presenta actividad citotóxica per se, mientras que por otro lado la PDT es efectiva para HeLa.
Palabras clave: ficobiliproteínas, carcinoma cervicouterino.
ABSTRACT
The phicobiliproteins are the main accessories pigments of red algae and of some cyanobacteria. They have a therapeutic value as immune-modulator, nevertheless there’s only a scarce use of them in cancer treatment.
PBs are proteins having linked to their cysteine residues lineal tetrapirrols prostetic groups. These groups have double conjugated links that allow electron transfer, thus they could be used as photo-sensibilizators in photo-dynamics therapy.
Due to the fact that cervical-uterus cancer is a serious problem of public health in Mexico, it is necessary to find less expensive options that allow the application of different therapies. Thus, the object of this work was to compare the answer of two cellular lines of cervical-uterus cancer (CaLo y HeLa) with the same PB concentrations, handling two possible treatments; in the first one, exposing them only to the PBs and, in the other one, with simultaneous exposition to irradiation with an argon laser.
A PBs extraction was made from a biomasa gram of Pseudoanabaena in phosfate buffer. The carachterization was made through the absorbing reading of the simple at 565, 620 and 650 nm to determine the PBs concentrations. To determine the effectiveness of PBs in PDT, 5X104 HeLa y CaLo cells were planted by well in microplates of 96 wells. The cells were exposed to the following PE dosages: 2.17x10-3, 4.35x10-3, 8.70x10-3, 8.7x10-3, 3.48x10-2, 6.96x10-2 mg/ml. After 3 hr of exposure they were irradiated with an argon laser at 127 J/cm2. After 24 hours cell viability was determined by the neutral red method both, in irradiated cells as well as in non irradiated ones. It was determined that for HeLa the two first dosages were safe, nevertheless when the cells were irradiated it was determined 46% of cellular death in both dosages. Within the highest dosages cellular death was from 48% to 57%. Nevertheless in CaLo no meaningful difference was observed between both treatments, showing a high mortality in both cases. We may conclude that the extract shows citatoxic activity per se, while, in the other hand, PDT is effective for HeLa.
Key words: phicobiliproteins, cervical-uterus cancer
INTRODUCCIÓN
Del total de los cánceres, el 20% son hereditarios y el 80% son iniciados por agentes medioambientales (compuestos químicos, radiaciones, virus), los cuales provocan una mutación en algún gen que permite a la célula ciertas ventajas en su crecimiento. Un cáncer se origina cuando clonas de células mutadas sobreviven y proliferan en forma inapropiada, rompiéndose el balance entre la proliferación celular y la apoptosis.
En algunas neoplasias intervienen oncogenes virales, como por ejemplo los oncogenes de los papilomavirus humanos (HPV) de alto riesgo en cáncer cervicouterino (CaCu). Estos virus favorecen la inestabilidad genómica de la célula infectada y la proliferación celular, al mismo tiempo que inhiben los procesos de apoptosis. El genoma de los HPV es de DNA de doble cadena, circular y formado por alrededor de 7,900 pares de bases. Los diferentes tipos de HPV tienen su genoma organizado de una forma similar, con genes de expresión temprana (E) y otros de expresión tardía (L) codificados por la misma cadena de DNA (es decir, transcritos en un sólo sentido). La región temprana codifica para las proteínas oncogénicas E6 y E7, para proteínas que se necesitan en la replicación del genoma viral (El, E2) y para una proteína (E2) que puede actuar como activador o represor de la transcripción de los oncogenes virales (E6, E7). Las oncoproteínas virales E6 y E7 inhiben la actividad de las proteínas antioncogénicas p53 y pRb, respectivamente (12,13).
Con base en la asociación con el cáncer genital, los HPV pueden clasificar en grupos de bajo riesgo (tipo 6,11), riesgo intermedio (tipo 31, 33, 35) o alto riesgo (tipo 16,18)(7).
El cáncer cervicouterino es un problema de salud pública en mujeres que viven en países con deficiencias en los programas de prevención oportuna de cáncer. En el ámbito mundial, se estima que se presentan 231,000 muertes cada año, 80% de las cuales ocurren en países pobres.
Una estimación conservadora calcula que la prevalencia global de casos clínicamente reconocidos de cáncer cervicouterino es de 1.4 millones, y que entre 3 a 7 millones de mujeres en el mundo pueden estar sufriendo displasia de alto grado.(7)
Debido a que puede mantener un periodo de latencia prolongado y en sus inicios no causar molestias, este se identifica ya en sus fases avanzadas, en las que las acciones terapéuticas son muy agresivas y poco efectivas. En México y Centroamérica se reportan las más altas tasas de incidencia a nivel mundial, con 44.4 casos x 100,000 mujeres. A este respecto, las tasas de mortalidad por CaCu en México durante el año 2,000, son iguales a las que se presentaron al inicio de la década de 1980, por lo que ha habido un nulo impacto de los programas de detección oportuna del cáncer en nuestro pais.7
Las ficobiliproteínas (PBs) son los principales pigmentos accesorios de las algas rojas y de algunas cianobacterias. Son ampliamente utilizadas como reactivos químicos fluorescentes, colorantes en alimentos y cosméticos.(1) Tienen un valor terapéutico como inmunomodulador y recientemente se ha incrementado el interés por su habilidad de revertir el fenotipo de multirresistencia a fármacos de varios tipos de células tumorales.(5) Las PBs son proteínas que tienen unidos a sus residuos de cisteína grupos prostéticos tetrapirroles lineales. Éstos absorben energía en la región visible del espectro (400-700nm)(3) y sus dobles enlaces conjugados les permiten la transferencia de electrones, por lo cual son aptos para su uso como fotosensibilizadores en la Terapia Fotodinámica (PDT). La PDT es una terapia contra el cáncer que aprovecha las ventajas que ofrece la interacción entre la luz, el oxígeno y un agente fotosensibilizador para inducir muerte en las células cancerosas por la formación localizada de especies reactivas de oxigeno (ROS).(10,11)
Debido a que en México el cáncer cervicouterino es un problema serio de salud pública, es necesario encontrar opciones que abatan los costos y permitan la aplicación de diferentes terapias. Así, el objetivo de este trabajo fue comparar la respuesta de dos líneas celulares de cáncer cervicouterino (CaLo y HeLa) a las mismas concentraciones de PBs, manejando dos posibles tratamientos; en el primero, únicamente exponiéndolas a las PBs y, en el otro, con exposición simultánea a las PBS y a la irradiación con un láser de argón.
METODOLOGÍA
Se realizó una extracción de ficobiliproteínas (PBs) a partir de un gramo de biomasa de Pseudoanabaena, en una solución amortiguadora de fosfatos.(2) La caracterización se realizó mediante la lectura de la absorbencia de la muestra a 565, 620 y 650 nm para determinar las concentraciones de ficocianinas (PC), ficoeritrinas (PE) y aloficocianinas (AP).(14) Para determinar la efectividad de las PBs en la PDT fueron sembradas 5x104 células HeLa (línea celular derivada de un carcinoma cervicouterino) por pozo, en microplacas de 96 pozos. Las células se expusieron a las siguientes dosis de PE: 2.17x10-3, 4.35x10-3, 8.70x10-3, 8.7x10-3, 3.48x10-2, 6.96x10-2 mg por mL de DMEM.
Después de 3h de exposición se irradiaron con un láser de argón a 127 J/cm2. Pasadas las 24 h se determinó la viabilidad celular por el método del rojo neutro en microplacas(8), tanto en las células irradiadas como en las no irradiadas. La línea celular CaLo se trabajó en las mismas condiciones.
Análisis estadístico: Todas las determinaciones se realizaron por cuadriplicado. Para determinar la diferencia entre las células irradiadas y sin irradiar, se utilizó la prueba no paramétrica de t de Wilcoxon.
RESULTADOS
En el extracto crudo se concluyo que de las PBs, la más abundante fue la ficoeritrina, que ocupó el 47.98% (0.286 mg/ml); le siguieron las ficocianinas, que estuvieron presentes en un 31.32 % (0.187 mg/ml); y, las menos abundantes fueron las aloficocianinas, que se encontraron en un 20.64% (0.123 mg/ml), de tal manera que se decidió estudiar a la ficobiliproteína más abundante. Así, todas las concentraciones a probar se basaron en la ficoeritrina C.
Se determinó que para las células Hela, las PBs sin irradiar en las dos primeras dosis (2.17x10-3 y 4.35x10-3 mg/ml) no provocaron muerte celular significativa, pero al ir aumentando las dosis se observó mayor muerte, encontrándose hasta un 44% en la dosis más alta (tabla 1); mientras que para las células Calo todas la dosis resultaron tóxicas (tabla 2) con un rango de mortalidad de 59.79% a 88.81%. Por lo que las PBs por sí solas son capaces de matar a las células cancerosas.
Posterior a la aplicación de la PDT en células HeLa se encontró que la muerte celular en las dosis seguras (2.17x10-3 y 4.35x10-3 mg/mL de PE), fue del 46% y 47% respectivamente (figura 1). En las dosis más altas la muerte celular fue del 48% al 57%. Al comparar el porcentaje de mortalidad entre las células irradiadas y las no irradiadas se determinó que la PDT, cuando utilizamos PBs e irradiamos con un láser de argón, mata significativamente (p<0.001) más células que cuando éstas se exponen a las PBs solamente. Para las células CaLo (figura 2), sin embargo, se observó que ninguna de las dosis empleadas es segura. Por otro lado, no presentó diferencia significativa (p>0.200) antes y después de la aplicación de la PDT.
Tabla 1. Porcentaje de mortalidad de las células HeLa expuestas a diferentes dosis de PBs.
Ficobiliproteína [mg/mL] |
% de mortalidad |
||
Ficoeritina-C |
Ficocianina-C |
Aloficocianina-C |
|
2.17x10-3 |
1.46 x10-3 |
9.61x10-3 |
0 |
4.35x10-3 |
2.92 x10-3 |
1.92x10-3 |
4.3 |
8.70x10-3 |
5.84x10-3 |
3.84x10-3 |
17.7 |
3.48x10-2 |
2.34x10-2 |
1.54x10-2 |
21.8 |
6.96x10-2 |
4.68x10-2 |
3.08x10-2 |
27.7 |
0.12 |
9.35x10-2 |
6.15x10-2 |
32.9 |
0.24 |
0.161 |
0.106 |
43.5 |
Tabla 2. Porcentaje de mortalidad de las células CaLo expuestas a diferentes dosis de PBs.
Ficobiliproteína [mg/mL] |
% de mortalidad |
||
Ficoeritina-C |
Ficocianina-C |
Aloficocianina-C |
|
2.17x10-3 |
1.46 x10-3 |
9.61x10-3 |
59.79 |
4.35x10-3 |
2.92 x10-3 |
1.92x10-3 |
62.55 |
8.70x10-3 |
5.84x10-3 |
3.84x10-3 |
84.94 |
3.48x10-2 |
2.34x10-2 |
1.54x10-2 |
88.08 |
6.96x10-2 |
4.68x10-2 |
3.08x10-2 |
85.31 |
0.12 |
9.35x10-2 |
6.15x10-2 |
82.46 |
0.24 |
0.161 |
0.106 |
88.81 |

Figura 1. Mortalidad de las células HeLa expuestas a diferentes dosis de PBs, irradiadas (□) y sin irradiar (▲). *Diferencia significativa entre grupos.
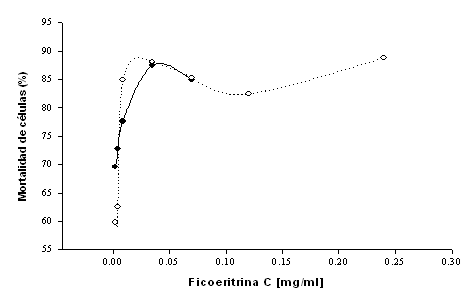
Figura 2. Mortalidad de las células CaLo expuestas a diferentes dosis de PBs, irradiadas (·) y sin irradiar (°).
DISCUSIÓN
El efecto citotóxico del extracto crudo de ficobiliproteínas, cuando éstas son irradiadas, puede ser atribuido principalmente a la ficoeritrina, debido a que de las 3 ficobiliproteínas, es la única que absorbe a las longitudes de onda en la que emite el láser de argón utilizado. Éste tiene 3 líneas, emite a 488, 496 y 514 nm. Se ha reportado que las ficobiliproteínas tienen varios máximos de absorción, así encontraron que las PE absorben a 498, 545-546 y 565-568, las APC 598, 629 y 650 nm y las PC absorben a 615 y 617.(4,9) También se ha demostrado que al excitarse son capaces de transferir altas cantidades de energía, por lo que podemos sugerir que la citotoxicidad observada en los ensayos con células HeLa es debida al efecto fotodinámico que se lleva a cabo al excitar a la PE.
En estudios anteriores relacionados con productos de cianobacterias y el tratamiento del cáncer, se ha encontrado que la ficocianina-C es capaz de inducir apoptosis,(6) por lo que no se descarta la idea de que la presencia de esta molécula en el extracto crudo ensayado en este trabajo, esté provocando parte de la muerte celular, por lo menos en las dosis mayores a 5.84x10-3 mg/ml de ficocianina y 8.70x10-3 mg/mL de ficoeritrina, en
las células HeLa, mientras que para CaLo esta puede ser la principal causa de muerte. Otro aspecto es que a las PBs se les ha atribuido la capacidad de revertir el fenómeno de multirresistencia a fármacos que presentan la mayoría de las células tumorales, así que la eficacia de la PDT puede también haber sido favorecido por esta propiedad del extracto probado.
Por otra parte se la reportado que CaLo es más susceptible que HeLa,(15) sin embargo, aun CaLo, sólo con la PBs a las mismas dosis utilizadas para HeLa, presentó mayor mortalidad, de tal manera que esto explica que después de la irradiación no aumentara la citotoxicidad debido a que la mayoría de las células ya habían muerto. Es importante señalar que la diferencia en el comportamiento de ambas líneas celulares, puede deberse a que CaLo posea un sistema antioxidante, por lo cual la irradiación no cause una diferencia significativa en cuanto a muerte celular.
CONCLUSIONES
En conclusión, al aplicar la PDT el efecto fotodinámico es debido únicamente a la ficoeritrina ya que es la única ficobiliproteína que absorbe a las longitudes de onda que emite el láser. Por otra parte el extracto crudo presenta una fuerte actividad citotóxica per se, como puede apreciarse para ambas líneas celulares y en especial en CaLo. Si bien se requieren más estudios al respecto, este trabajo abre una nueva rama de investigación citotóxica, con lo que se podrían desarrollar nuevos fármacos con alta efectividad sobre células tumorales.
AGRADECIMIENTOS
Los autores agradecen a la Biol. Celia Flores Granados del Departamento de Botánica por la identificación de la cepa de cianobacteria y a la QBP. Yavné Zamora Juárez por su ayuda en la realización de algunas de estas pruebas. Agradecen también al personal de la Central de Espectroscopia de la Escuela Nacional de Ciencias Biológicas del IPN, a la IBQ Esther Ayala Maycotte del Depto de Física del CINVESTAN-IPN, por las facilidades prestadas para la lectura de las muestras e irradiación de las células respectivamente.
Este trabajo fue financiado por el proyecto CONACYT No I39313-I y parcialmente financiado por el proyecto CGPI No: 20040129 ERG, ACO son becarios SNI. ROR es becario de COFAA.
REFERENCIAS
1. Bermejo R.R., Alvarez P.J.M., Acién F.F.G., Molina G.E. “Recovery of pure B- phycoerythrin from the microalga Porphyridium cruentum”. J. Biotechnology, 93:73-85, 2000.
2. Boussiba S., Richmond A.E. “Isolation and characterization of phycocyanins from the blue-green alga spirulina platensis”. Arch. Microbiol., 120:155-159. 1979.
3. Cañizares V. R.O., Rios L. E., Olvera R. R., Ponce N.T., Marque R.F.; “Fuentes Microbianas De Pigmentos”. Rev. Lat.-Amer. Microbiol., 40: 87-107, 1998.
4. MacColl R., Guard-Friar D. (1987), Phycobiliproteins, CRC Press, Boca Raton, Florida, USA.
5. Moreliere et al. “Tolyphorphin: A Natural Product Cromo Cianobacteria With Potent Photosensitizing Activity Against Tumor Cells In Vitro An In Vivo”, Cancer Research, 58: 3571-3578, 1998.
6. Pardhasaradhi B.V.V, Mubarak A.A., Leela A.K, Reddanna P., Khar A. “Phycocyanin-mediated apoptosis in AK-5 tumor cells involves down-regulation of Bcl-2 and generation of ROS”. Oncol Res, 6:211-218, 1994.
7. Perez Tamayo R.(2003), El Cáncer en México, Primera edición, El Colegio Nacional, México, pp. 129-234, 407-442.
8. Ramón G.E., Deleón R.I., Martinez G.L.A., Pérez Z.A.J, “In Vitro study of biosintesis of protoporphyrin IX induces by d-aminolevulinic acid in normal and cancerous cells of the human”. Archives of Medical Research, 30 (3):163-170, 1999.
9. Rowan SR (1989). Photosynthesis Pigments of Algae, Cambridge University Press, Cambridge, UK.
10. Sakharov Dv, Bunschoten A, Van Weeiden H, Wittz Kw, “Photodynamic Treatment And H2O2-Induced Oxidative Stress Result In Different Patterns Of Cellular Protein Oxidation”, Eur J Biochem., 720(24):4859-65, 2003.
11. Samia, Anna C. S.; Chen, X.; Burda, C.; “Semiconductor Quantum Dots For Photodynamic Therapy”, Journal Of The American Chemical Society, 125(51): 15736-15737, 2003.
12. Salcedo M, et al. “Reduced retinoblastoma gene expression correlates with human papillomavirus- associated squamous uterine-cervix carcinomas.” Modern Pathology, 17: 1031–1037, 2004.
13. Stöppler H, Stöppler MC y Schlegel R., ”Transforming proteins of papillomaviruses”. Intervirology, 37: 168-179, 1994.
14. Tandeuau de Marsac N., Houmard J. “Complementary chromatic adaptation: physiology conditions and action spectra” Methods in enzimology, 167:318- 328,1988.
15. Zamora-Juarez Y., Perez-Zapata A.J., Solano-Rodriguez L., Ramon-Gallegos E., Cruz-Orea A., “Photodinamic effect of modulated and continuos LASSER radiation on cancerous cells cultivated in vitro”. Physica Scripta. Vol 71, 1-4, 2005.