
Judith Pacheco-Yépez
Jefe del Área Ciencias de la Salud Investigadora. Facultad de Medicina. Universidad La Salle
Adrián Rondán-Zárate Investigador. Facultad de Medicina. Universidad La Salle
Mineko Shibayama Víctor Tsutsumi
Centro de Investigación y Estudios Avanzados del Instituto Politécnico Nacional.
Rafael Campos-Rodríguez
Departamento de Bioquímica. Escuela de Medicina. Instituto Politécnico Nacional.
Recibido : Agosto de 2005. Aceptado: Octubre de 2005
RESUMEN
La lectina de Entamoeba Histolytica se ha involucrado de manera importante en la patogenia de la amibiasis y se cree que participa en la adherencia de los trofozoítos a las células blanco. Además, se describe que la lectina puede dañar directamente a las células blanco. Por otro lado, el papel de los anticuerpos en la inmunidad protectora es controversial. En el presente estudio nosotros analizamos si la lectina se une a la superficie de los hepatocitos y los daña directamente; y, por otra parte, si los anticuerpos protegen del daño mediado por la lectina o bien, si pueden contribuir al daño de los hepatocitos.
Se analizaron las características de la interacción in vitro entre los trofozoítos y los hepatocitos de hámster, la especificidad de la unión mediante ensayos de competencia, incubando previamente con diferentes azúcares o bien con anticuerpos dirigidos contra la lectina. También se analizó el efecto de la lectina sobre la viabilidad y funcionalidad de los hepatocitos y el papel de los anticuerpos específicos hacia la lectina en fenómenos de protección.
Los resultados mostraron que cuando la lectina se unió a la superficie de los hepatocitos, algunos tenían signos de daño celular, principalmente presentándose cambios en la morfología celular y la presencia de núcleos picnóticos. Por otro lado, también se determinó que la lectina causaba citotoxicidad directa en los hepatocitos y, por último, se observó que los azúcares lactosa y NAcGal, así como los anticuerpos policlonales anti lectina Gal/GalNAc fueron capaces de inhibir la adhesión amibiana y en consecuencia reducir el daño en el cultivo primario de hepatocitos de hámster.
Palabras Clave: Entamoeba histolytica, lectina, cultivo primario de hepatocitos, anticuerpos, carbohidratos
ABSTRACT
The Entamoeba histolytica Gal/GalNAc lectin is an important molecule involved in the pathogenesis of amoebiasis. It plays a role in the adherence of Entamoeba histolytica trophozoites to the target cells. Moreover, the lectin can damage directly the target cells. On the other hand, the role of the antibodies in the amoebiasis protection is controversial. Therefore, in the present work we analyzed the effect of the lectin in hepatocyte bindings. We studied also the role of antibodies in protection assays or if they contribute to hepatocytes damage.
We analyzed the characteristic of the in vitro interactions between E. histolytica trophozoites and hepatocytes using hepatocytes primary cultures, the specificity binding assayed studies we used different carbohydrates and anti-lectin antibodies. Finally, we studied the effect of lectin in hepatocytes viability and function, and the possible role of the anti-lectin antibodies in protection assays.
When lectin was bound to the hepatocytes surface, some of them showed signals of cellular damage, displaying morphological changes and an important number of hepatocytes showed picnotic nucleus. On the other hand, when lactose, N-acetyl Galactose and polyclonal anti Gal/GalNAc lectin antibodies were used before the interaction of amoebas with the hepatocytes monolayer, they were able to inhibit the adhesion to the target cells, therefore, we conclude that these molecules reduced significantly the damage of the primary hamster culture.
Key words: Entamoeba histolytica, lectin, hepatocytes primary cultivation, antibodies, carbohydrates.
INTRODUCCIÓN
La adherencia es un requisito para que las amibas puedan destruir a las células blanco (1,2). Las moléculas que participan en el proceso de adhesión son las lectinas (3,4,5,6,7,8,9,10). La interacción se lleva a cabo por el reconocimiento de residuos de carbohidratos en la membrana de las células blanco. Los principales azúcares involucrados son la N-acetil-D-galactosamina (GalNAc), la galactosa terminal (Gal), y las unidades de lactosamina (Gal-1,4-GlNAc) (11,5,6,12,13). Sin embargo, no parece existir reconocimiento de los residuos de N-acetil-D-glucosamina terminal (GlcNAc). Todo lo anterior sugiere que una interacción importante entre la amiba y sus células blanco se lleva a cabo por medio de lectinas o adhesinas específicas para Gal y GalNAc.
Por otro lado, E. histolytica activa el sistema de complemento pero es resistente al complejo de ataque a la membrana (C5b-9). Se ha visto que cuando se utilizan anticuerpos contra la lectina con especificidad para Gal se provoca un incremento en la lísis de los trofozoítos por C5b-9, sugiriendo que el sitio activo de la lectina que une carbohidratos puede contribuir a la habilidad de la lectina de bloquear el ensamble del complejo de ataque a la membrana. La participación de la lectina Gal/GalNAc en la adherencia, citólisis y resistencia al complemento sugieren que podría ser un buen candidato para vacunas; así, una vacuna anti-amibiana impediría la adherencia a la mucosa colónica y podría prevenir la colonización y el daño (14).
Existen resultados controversiales en cuanto a la protección de los anticuerpos contra la amibiasis. Por un lado, se ha sugerido que la lectina Gal/GalNac es capaz de inducir una respuesta inmuno protectora ya que los anticuerpos específicos pueden inhibir la adherencia de E. histolytica y la citólisis subsecuente de las células blanco. Un gran número de proteínas amibianas son inmunogénicas, de manera que sujetos con absceso hepático amibiano tienen anticuerpos circulantes contra ellas, incluyendo anticuerpos contra las lectinas y adhesinas (15,16,17,18,19). Sin embargo, los anticuerpos séricos no curan la infección y tampoco evitan las reinfecciones, sobre todo del intestino (20). Adicionalmente, los anticuerpos pueden, al menos teóricamente, favorecer el daño hepático. En el absceso hepático amibiano experimental desarrollado en el hámster hay correlación entre el título de anticuerpos y la magnitud del daño (21). En jerbos inmunizados con la lectina de 170 kDa y posteriormente retados intrahepáticamente con trofozoítos virulentos de E. histolytica, la frecuencia de abscesos es mucho menor en comparación con los controles, sin embargo, los abscesos que se forman en los animales inmunizados son significativamente más grandes con relación a los que se forman en los testigos (22). También se ha reportado que los anticuerpos dirigidos contra un epítope en la cadena pesada de la lectina de la amiba que es especifica para D-galactosa y N-acetil D-galactosamina, incrementa el tamaño de los abscesos hepáticos en jerbos (epítope no protector); por otro lado, los anticuerpos dirigidos contra un epítope diferente confieren protección; es decir, el tamaño de los abscesos es menor (epítope protector) (23).
Con los antecedentes mencionados anteriormente, en este trabajo se analizó si la lectina Gal/GalNac de E. histolytica, es capaz unirse a la superficie de los hepatocitos e iniciar alteraciones morfofuncionales o daño y, por otro lado, si los anticuerpos específicos para esta lectina pueden evitar o contribuir a la destrucción de los hepatocitos, dependiendo del epítopo reconocido y del tiempo de aparición de los anticuerpos.
MATERIAL Y MÉTODOS
Purificación de la lectina Gal/GalNac.
La lectina con especificidad para Galactosa y N-acetil-D-galactosamina se purificó por cromatografía de afinidad siguiendo el protocolo previamente reportado (6).
Cultivo primario de hepatocitos de hámster.
Los animales se anestesiaron con pentobarbital sódico. La cavidad abdominal se abrió y expuso la vena porta. El hígado se perfundió a través de la vena porta con una solución que contenía EGTA y colagenasa siguiendo la técnica reportada (24). Los hepatocitos se incubaron a 36.8 oC, en una atmósfera de 9 % de CO2, las células no adheridas se eliminaron.
Interacción de trofozoítos de E. histolytica con hepatocitos de hámster.
La interacción se realizó con hepatocitos sembrados sobre cubreobjetos cubiertos con colágena tipo I, la relación de interacción utilizada fue de 8 hepatocitos por 1 amiba. Los tiempos de interacción empleados fueron 5, 15, 30 y 60 min. La viabilidad de las amibas se revisó mediante exclusión con azul tripano. Las muestras fueron fijadas con paraformaldehído. Estas muestras fueron procesadas para la detección de lectina mediante inmunocitoquímica.
Interacción de la lectina Gal/GalNac con hepatocitos de hámster.
Se interaccionaron hepatocitos de 24 h de cultivo con 4mg de la lectina purificada, los tiempos de interacción fueron de 5, 15, 30 y 60 min. Las muestras se fijaron con paraformaldehído al 1.5% para posteriormente realizar una inmunocitoquímica utilizando anticuerpos anti lectina.
Inmunocitoquímica.
La peroxidasa endógena se bloqueó con metanol-H2O2, los sitios no específicos se bloquearon con suero fetal bovino al 10%. La inmunodetección se llevó a cabo con un anticuerpo monoclonal anti lectina diluidos 1:50 en PBS-Tween-suero fetal bovino, las muestras se incubaron toda la noche a 4oC. Al día siguiente se agregó el conjugado de peroxidasa chivo anti IgG de ratón, diluido 1:500, después de una hora se reveló con DAB. Las inmunotinciones se examinaron por microscopia de luz.
Efecto citotóxico de trofozoítos de E. histolytica sobre hepatocitos de hámster.
La interacción entre los trofozoítos de E. histolytica y los hepatocitos de hámster se realizó a una relación de 1:8 empleando placas de 24 pozos. Los tiempos de interacción trabajados fueron de 15, 30, 40 y 60 minutos. Transcurrido el tiempo de interacción se adiciono MTT (3-(4,5-Dimetilthiazol-2-yl)-2,5-difeniltetrazolium bromuro) 5mg/ml. Se incubó 30 minutos a 36.8oC y CO2 al 8%. Se adicionaron 100ml de DMSO por pozo, se agitó un minuto y se leyó en un espectrofotómetro a 540nm.
Efecto citotóxico de la lectina de E. histolytica sobre los hepatocitos de criceto.
Se interaccionaron hepatocitos con la lectina Gal/GalNac de E. histolytica. Los tiempos de interacción fueron de 5, 15, 30 y 60 min. El control utilizado fue otra lectina no relacionada (concanavalina A) a la misma concentración que la lectina amibiana. Posterior a la interacción se adicionó el MTT y se midió la liberación de colorante en un espectrofotómetro a 540nm.
Bloqueo del daño de los hepatocitos por anticuerpos policlonales (IgG) anti lectina
Los trofozoítos se preincubaron con la IgG anti lectina 25-50mg durante 5 minutos, y enseguida se añadieron a la monocapa de hepatocitos. Después de incubar durante 30 y 60 minutos, se adicionó el MTT e incubó durante 30 minutos. Finalmente se adicionó el DMSO, las muestras se leyeron a 540 nm. Los controles fueron amibas que fueron preincubadas con suero normal de chivo.
Daño provocado a los hepatocitos mediado por anticuerpos policlonales (IgG) anti lectina y complemento
Los hepatocitos y las amibas se hicieron interaccionar durante 15 minutos a una relación de 8:1, transcurrido este tiempo se adicionó simultáneamente la IgG anti lectina a concentraciones de 25-50mg y complemento a concentraciones de 5 y 50mg. En otros experimentos, la lectina (10 mg) se hizo interaccionar con los hepatocitos durante 15 minutos a 37oC, después se adicionaron los anticuerpos anti lectina (50 mg) y complemento. Después de incubar a 36oC y 8% de CO2 durante 15 y 30 minutos, se adicionó el MTT durante 30 minutos, y las muestras se leyeron a 540 nm. Los grupos testigos carecían de anticuerpos específicos y complemento.
Ensayos de bloqueo de la adhesión entre las amibas y el cultivo primario de hepatocitos mediante el uso de azúcares.
Las amibas fueron preincubadas durante 30 minutos con diferentes carbohidratos: Galactosa, Manosa, Lactosa, N-acetil Galactosamina (NacGal), N-acetil Glucosamina (NacGlu) y Melobiosa a concentraciones de 50, 100 y 200mM. Posteriormente las amibas se agregaron a la monocapa de hepatocitos y después de incubar por 30 min, se adicionó a la placa MTT disuelto en medio DMEM y se incubó a 36.8oC durante 30 min.
Se adicionó DMSO a cada pozo para liberar los cristales de formazan. Después de 5 min se leyeron las muestras espectofotométricamente a una longitud de onda de 540 nm.
RESULTADOS
Purificación de la lectina Gal/GalNAc
La lectina Gal/GalNAc se purificó mediante cromatografía de afinidad empleando anticuerpos monoclonales específicos para la subunidad pesada (170 kDa) de la lectina. La caracterización bioquímica se realizó por medio de SDS-PAGE (Figura 1); la tinción del gel reveló la presencia de las dos principales subunidades de la lectina, las cuales presentaron las masas moleculares estimadas, 170 y 35 kDa.

Las proteínas eluídas de la columna de afinidad se separaron mediante SDS-PAGE al 10%, bajo condiciones reductoras con b-mercaptoetanol. Carril 1 marcadores de peso molecular. Carril 2 y 3 muestran las migraciones de la subunidad pesada de 170 kDa y de la subunidad ligera de 35 kDa.
Interacción de trofozoítos de E. histolytica y hepatocitos de hámster
El progreso en la destrucción de los hepatocitos por acción de las amibas se siguió mediante un ensayo de citotoxicidad que se basa en la reducción del MTT. Los resultados muestran (Figura 2) que desde los primeros minutos de interacción entre las amibas y los hepatocitos se observa una drástica disminución en la viabilidad de los hepatocitos. A los quince minutos de interacción hubo disminución en un 60% de la reducción del colorante lo cual indica que un gran porcentaje de hepatocitos fueron destruidos por las amibas. Este porcentaje no aumento significativamente a los 30, 40 y 60 minutos de interacción.

Figura 2.- Interacción de trofozoítos de Entamoeba histolytica y hepatocitos de hámster.
Los hepatocitos de hámster se cultivaron durante 24 horas. Trofozoítos de E. histolytica recientemente obtenidos se colocaron sobre la monocapa a relación de 1:8 trofozoítos/hepatocitos. Los tiempos de interacción fueron de 15, 30, 40 y 60 minutos. Al final del periodo se determino la reducción del MTT para cuantificar la viabilidad residual.
Análisis microscópico de la interacción in vitro de hepatocitos y trofozoítos vivos de
Entamoeba histolytica
Desde los primeros minutos de interacción entre el cultivo primario de hepatocitos de hámster y los trofozoítos de E. histolytica se observó un cambio morfológico importante en el cultivo. A los 5 minutos los hepatocitos que habían sido contactados por las amibas empezaban a manifestar signos de daño, se redondeaban y presentaban algunas vesículas en su membrana. A los 15 minutos de interacción el daño al cultivo de hepatocitos era mucho más evidente, los hepatocitos en contacto con las amibas presentaban múltiples vesículas en su membrana, además mostraban pérdida de su arquitectura poliédrica característica, y se observó la presencia en el cultivo de restos celulares. En hepatocitos que no estaban en estrecho contacto con las amibas también manifestaban signos daño; se redondeaban, perdían su forma característica y algunos mostraban sus núcleos desplazados a la periferia. A los 30 minutos el daño progresaba y se observó un número importante de hepatocitos desprendidos, mayor cantidad de detritus celulares, los hepatocitos dañados presentaban núcleos con apariencia picnótica y se perdían las uniones entre los mismos. A los 60 minutos el daño fue mucho mayor, una gran cantidad de hepatocitos adquirían formas elongadas y presentaban núcleos picnóticos, la mayoría de los hepatocitos se habían desprendido y las áreas líticas en el cultivo eran más extensas. El daño ocasionado por las amibas al cultivo de hepatocitos se incrementaba con el transcurso del tiempo (Figura 3).
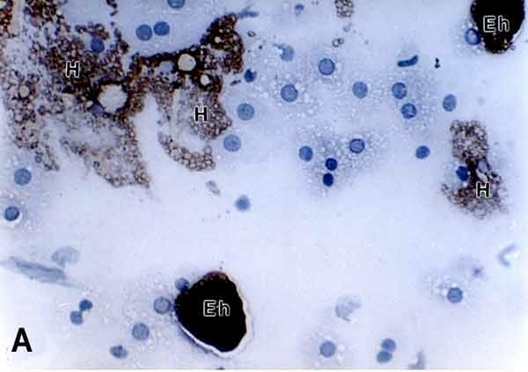
(A) Quince minutos de interacción. Trofozoítos de E. histolytica (Eh) y algunos hepatocitos que muestran signos de daño (H) se marcan fuertemente a la lectina. El
anticuerpo monoclonal anti lectina Gal/GalNAc marca hepatocitos distantes a las amibas (H). Otros hepatocitos con signos de daño y en contacto con las amibas no se marcan.
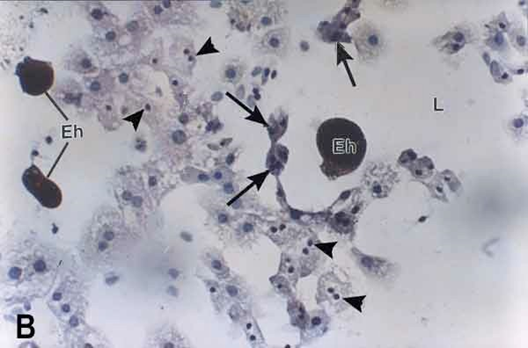
(B) Treinta minutos de interacción. Amibas (Eh) y hepatocitos marcados a la lectina se observan elongados (flechas) y con núcleos picnóticos (cabezas de flecha). Se
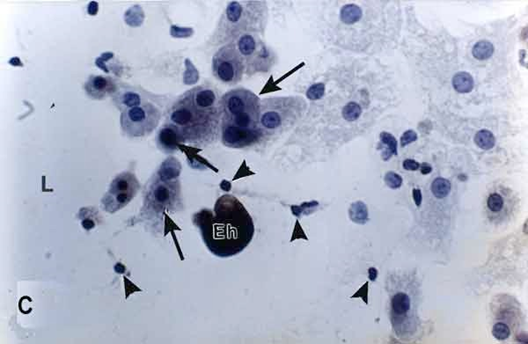
presentan zonas líticas (L). (C) Una hora de interacción. Grandes extensiones de zonas líticas (L) en la monocapa. Trofozoíto intensamente marcado (Eh) y hepatocitos marcados con la lectina (flechas). Se observan núcleos sueltos en las áreas líticas (cabezas de flecha).
Interacción de la lectina Gal/GalNAc con el cultivo primario de hepatocitos de hámster
Al analizar las interacciones de la lectina purificada con el cultivo primario de hepatocitos observamos un daño menor al presentado por las células del parénquima hepático cuando se interaccionaron con amibas íntegras. A los 5 min de interacción los hepatocitos presentaban cambios morfológicos que fueron indicativos de daño (Figura 4); a los 15 min algunos de los hepatocitos presentaban pequeñas vesículas en su membrana, aunque continuaba siendo menos evidente que cuando se les adicionaron trofozoítos de E. histolytica, a los 30 minutos el número de hepatocitos con signos de daño incremento, los hepatocitos perdían su arquitectura característica y adquirían formas redondeadas, algunos de ellos presentaban desplazamiento de los núcleos, además se observó un número creciente de hepatocitos que perdían su adhesividad y se desprendían de la superficie de la caja, a los 60 min el daño observado no fue mucho mayor al que presentaban los hepatocitos a los 30 min de interacción. Los hepatocitos testigo que fueron interaccionados con el amortiguador en el cual se encontraba diluida la lectina no presentaron daño alguno, mantuvieron su morfología característica y no perdieron adhesividad. Los resultados observados a microscopía óptica muestran cierto daño morfológico inducido por la lectina purificada al cultivo primario de hepatocitos de hámster; no obstante, el daño fue mucho menor que cuando se interaccionó con la amiba completa.
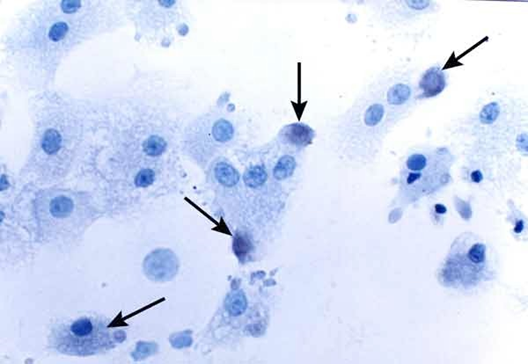
Cinco minutos de interacción. La marca se encuentra presente en algunas áreas de la superficie hepática (flechas), otros hepatocitos no se marcan a la lectina. Algunos hepatocitos presentan signos de daño pierden su arquitectura característica y presentan núcleos picnóticos.
Efecto citotóxico directo de la lectina sobre los hepatocitos de hámster
Para analizar el posible efecto citotóxico directo de la lectina se hicieron ensayos de citotoxicidad in vitro. A la monocapa de hepatocitos se les añadió la lectina y después de incubar desde 5 hasta 60 minutos se realizó el ensayo de viabilidad por el método de MTT. Se observó una reducción significativa (*) de la viabilidad de los hepatocitos como consecuencia de la interacción de la lectina a los 5, 15 y 30 minutos de interacción. A los 60 min de iniciada la interacción el efecto citotóxico no fue mucho mayor al observado en los otros tiempos de incubación (Figura 5).

Los hepatocitos de hámster se incubaron con la lectina Gal/GalNAc (4 mg) durante diferentes tiempos y al final se determinó la viabilidad de los hepatocitos mediante ensayo con MTT. Hubo reducción significativa (*, p < 0.05) de la viabilidad de los hepatocitos como consecuencia de la interacción con la lectina purificada, a los 5, 15 y 30 minutos.
Anticuerpos IgG anti lectina inhiben el daño de los hepatocitos por E histolytica
Con el fin de establecer el papel de los anticuerpos en la adherencia de los trofozoítos a la capa de hepatocitos, los trofozoítos se incubaron durante cinco minutos con anticuerpos policlonales de conejo de la clase IgG anti lectina y enseguida se añadieron a la monocapa de hepatocitos. Después de incubar por 30 y 60 min, se realizó el ensayo de viabilidad de los hepatocitos. Como se observa (Figura 6), los anticuerpos IgG específicos inhibieron el daño de los hepatocitos. Por el contrario, la IgG de un animal no inmunizado no tuvo el mismo efecto.

Figura 6.- Anticuerpos IgG anti lectina inhiben la acción citotóxica de las amibas sobre los hepatocitos. Los anticuerpos IgG anti lectina (25 mg/ ml) inhibieron significativamente ( *, p< 0.05) la adhesión de los trofozoítos a los hepatocitos, a partir de los 30 minutos de incubación.
Los anticuerpos anti lectina y el complemento no aumentan el daño de los hepatocitos Los trofozoítos se hicieron interaccionar por 15 minutos con la IgG anti lectina y posteriormente se añadieron a la monocapa de hepatocitos junto con el complemento, después de incubar 30 minutos se midió la viabilidad. No se observó citotoxicidad mediada por anticuerpos ya que no se incrementó el daño de los hepatocitos (Figura 7). En forma similar cuando se incubaron los hepatocitos con lectina y posteriormente se adicionaron los anticuerpos IgG anti lectina y complemento, no se incremento el daño de los hepatocitos (Figura 8).

Figura 7. Los anticuerpos anti lectina y el complemento no dañan a los hepatocitos previamente incubados con trofozoítos. Los hepatocitos y las amibas se hicieron interaccionar durante 15 minutos a una relación de 8:1, transcurrido este tiempo se adicionó la IgG anti lectina (25-50mg) y complemento (5 y 50mg). No hubo efecto significativo de los anticuerpos y complemento sobre la viabilidad de los hepatocitos.

Figura 8. Los anticuerpos anti lectina y el complemento no dañan a los hepatocitos previamente incubados con lectina. La lectina (10 mg) se hizo interaccionar con los hepatocitos durante 15 minutos a 37oC. Después se adicionan los anticuerpos anti lectina (50 mg) y complemento. Después de incubar 30 minutos se midió la viabilidad. No hubo efecto significativo de los anticuerpos y complemento sobre la viabilidad de los hepatocitos.
La lactosa inhibe el daño de los hepatocitos causado por trofozoítos de E. histolytica
Para analizar el efecto de la inhibición de la función de la lectina amibiana por carbohidratos, los trofozoítos se incubaron con diferentes concentraciones de carbohidratos (NacGlu, manosa, galactosa, melobiosa, NAcGal y lactosa) y posteriormente se agregaron a la monocapa de hepatocitos de hámster. La viabilidad de los hepatocitos disminuyó aproximadamente en un 55% a los 30 minutos de interacción con trofozoítos no preincubados con carbohidratos (Figura 9). Cuando las amibas fueron preincubadas con los carbohidratos NacGlucosamina, manosa, galactosa y melobiosa a la concentración de 50mM hubo un ligero restablecimiento de la viabilidad de los hepatocitos, ya que aproximadamente un 64-68% de los hepatocitos permanecieron viables a los 30 minutos de interacción. Sin embargo, solamente la NAcGal a concentración de 200mM y la lactosa a concentraciones de 100 y 200 mM fueron capaces de bloquear de manera significativa el daño de los hepatocitos de hámster, ya que la viabilidad de los mismos se incremento a 80 y 100% respectivamente.

Figura 9.-Inhibición por azúcares del daño de los hepatocitos. Las amibas se incubaron con diferentes concentraciones de varios azúcares. Posteriormente las amibas se añadieron al cultivo de hepatocitos y transcurridos 30 minutos de incubación se realizó el ensayo de viabilidad empleando MTT. Los resultados se muestran como la media y la desviación estándar (*, P < 0.05; **, P < 0.01).
DISCUSIÓN
Nuestro trabajo demuestra la unión de la lectina Gal/GalNAc de Entamoeba histolytica a el hepatocito, el efecto que provoca la unión de la lectina en el hepatocito y el papel que desempeñan los anticuerpos anti-lectina Gal/GalNAc y carbohidratos sobre el evento de adhesión.
Mediante inmunocitoquímica observamos la presencia de la lectina Gal/GalNAc sobre la superficie y dentro de los hepatocitos de hámster provenientes de cultivo primario, sugiriéndonos que las células parenquimatosas expresan glicoproteínas que son capaces de unir a la lectina Gal/GalNAc y que la molécula puede ser introducida al citoplasma de la célula. La lectina se distribuyó de manera heterogénea, en algunos hepatocitos se observó un intenso marcaje mientras que en otros la lectina no se unió. Esto sugiere que existen diferencias en la expresión de glicoproteínas en el hepatocito a las cuales se puede unir la lectina Gal/GalNAc. Los hepatocitos presentan diferencias morfofuncionales y bioquímicas dependiendo de su localización zonal en el lóbulo hepático (zona periportal, zona media y zona pericentral) (25), por tanto no es extraño que observemos diferencias con respecto a la unión de la lectina Gal/GalNAc en el hepatocito. El patrón de distribución de la lectina purificada en el hepatocito también se presentó de manera diferencial, la lectina une algunas áreas del hepatocito y en forma de parches sobre la superficie hepática, esto pudiera estar relacionado con la expresión diferencial de glicoproteínas en los diferentes dominios de la membrana plasmática del hepatocito (dominio lateral, perisinusoidal y canalicular) (25). Los hepatocitos localizados a cierta distancia de los trofozoítos de E. histolytica mostraron también marca a la lectina lo que apoya la idea de que exista un proceso de secreción y difusión de la lectina hacia la vecindad del parásito. Nuestros resultados se correlacionan sólo en parte con aquellos reportados por Leroy y cols. (26) en donde de manera indirecta mediante el uso del anticuerpo monoclonal CD6 dirigido contra un antígeno amibiano, detectan la unión del antígeno a la superficie lateral de células epiteliales, no obstante esto, los anticuerpos monoclonales y policlonales dirigidos contra la lectina fueron incapaces de marcar las células epiteliales. El mecanismo molecular por el que la lectina se une y difunde hacia el hepatocito no es claro a la fecha.
Nuestros resultados nos indican que la unión de la lectina por las células blanco podría estar relacionada con el efecto citopático del parásito, dado que un importante número de hepatocitos que unen a la lectina Gal/GalNAc muestran cambios morfológicos sugestivos de daño celular, presentan vacuolización, pérdida de arquitectura, redondeamiento y presencia de núcleos picnóticos. El daño mediado por lectinas a las células blanco se ha mencionado con anterioridad en la literatura (27, 28, 29, 30, 31), donde las lectinas participan en el reconocimiento y adhesión de la célula blanco, esta adhesión es un prerrequisito para la colonización e invasión de las células del huésped.
Los resultados observados a nivel de microscopia de luz de las interacciones de hepatocitos con los trofozoítos o la lectina purificada correlacionan con los ensayos de citotoxicidad, es decir, durante la interacción de las amibas con el cultivo primario observamos una disminución en la viabilidad de la monocapa de hepatocitos. En la interacción de la amiba con los hepatocitos hubo una disminución abrupta del porcentaje de reducción del MTT, la viabilidad disminuyó más del 60% desde los primeros minutos de interacción, esto correlaciona con reportes en donde se muestra el daño ocasionado por E. histolytica sobre diferentes monocapas de células (32, 33). La interacción de la lectina purificada con el cultivo de hepatocitos indujo una disminución en el porcentaje de células hepáticas viables (25%) esto se relacionó de manera directa con las observaciones morfológicas realizadas por microscopia de luz en donde el número de células dañadas fue menor que el observado cuando las interacciones se realizaron con trofozoítos íntegros. La variabilidad observada en el daño inducido a los hepatocitos por las amibas y la lectina purificada puede deberse a que la lectina Gal/GalNAc participe junto con otras moléculas amibianas en el efecto citotóxico observado en la célula blanco. No obstante esto, la captura de la lectina Gal/GalNAc constituye un importante componente del efecto citopático del parásito.
Recientemente se utilizaron inhibidores específicos para demostrar la participación de tres tipos de moléculas en el efecto citotóxico de E. histolytica sobre monocapas de células MDCK (34), el único inhibidor que bloqueo la perdida de resistencia transepitelial provocada por la amiba fue la galactosa, lo que sugiere que la lectina Gal/GalNAc constituye un importante factor de citotoxicidad. También se ha mencionado que la lectina Gal/GalNAc participa en el proceso citolítico, debido a que durante la incubación
de la lectina con las células CHO se observa un aumento en la concentración intracelular de Ca2+ similar a la que induce la amiba, además, al adicionar D-galactosa se bloquea
completamente el flujo de Ca2+ y el evento citolítico (35). Finalmente, dentro de las alteraciones morfológicas que se observaron en el cultivo primario de hepatocitos que fue interaccionado con trofozoítos y lectina, se manifestó la presencia de núcleos picnóticos, lo que es sugestivo de un fenómeno apoptótico. Se ha mencionado que E. histolytica es capaz de inducir muerte celular programada. En el modelo de absceso hepático amibiano producido en ratones con inmuno deficiencia severa combinada (SCID), la apoptosis inducida por E. histolytica no requiere del ligando Fas/Fas, ni del TNF a (36).
Así mismo, se ha observado que un inhibidor de caspasas en el modelo de absceso hepático amibiano en el ratón SCID reduce de manera significativa el tamaño de los abscesos hepáticos lo que indica que en la formación del absceso hepático amibiano la apoptosis juega un papel significativo (37).
Con respecto a la lectina Gal/GalNAc de E. histolytica se observó que la destrucción de la línea celular mieloide murina (FDC-P1) por trofozoítos de E. histolytica es dependiente de contacto, con inducción de muerte apoptótica, y que este proceso es inhibido con galactosa lo que sugiere un posible papel de la lectina Gal/GalNAc durante dicho proceso (38).
Con la finalidad de establecer la participación de la lectina Gal/GalNAc durante el evento de adhesión de E. histolytica y el daño provocado en el cultivo primario de hepatocitos de hámster se realizaron ensayos de bloqueo de citotoxicidad utilizando anticuerpos policlonales dirigidos contra la lectina, el bloqueo de la adhesión y el daño se midió de manera indirecta mediante ensayos de citotoxicidad. La preincubación de las amibas con IgG anti lectina Gal/GalNAc bloqueo el proceso de daño y permitió un incremento significativo de la viabilidad de los hepatocitos, lo que nos sugiere que al igual que en otros ensayos de interacción in vitro, la lectina Gal/GalNAc participa de manera importante en el evento de adhesión y en consecuencia en el daño ocasionado por el parásito. Se sabe que los anticuerpos monoclonales C12 y 1G7 anti lectina Gal/GalNAc bloquean la adherencia de trofozoítos de E. histolytica a células de ovario de hámster chino (CHO) y a mucinas colónicas, en tanto que el anticuerpo monoclonal H85 únicamente inhibe la adhesión a células CHO lo que nos muestra diferencias en la unión de la lectina Gal/GalNAc dependiendo del tipo celular (39). Trofozoítos de E. histolytica
preincubados con anticuerpos monoclonales anti lectina Gal/GalNAc fueron incubados con células CHO marcadas radioactivamente (51Cr), los anticuerpos bloquearon la adhesión y la citotoxicidad hacia las células CHO (40). Así mismo, fragmentos del gen
que codifica para la subunidad pesada de la lectina se expresaron como proteínas recombinantes y se reaccionaron con anticuerpos monoclonales anti lectina, los anticuerpos reconocieron diferentes epítopes de la subunidad pesada y tuvieron diversos efectos sobre la adhesión y citotoxicidad; los anticuerpos que reaccionan con el dominio rico en cisteína de la lectina, inhibieron la adherencia, citotoxicidad y redujeron la resistencia al componente C5b-9 del complemento (41). Nuestros resultados y los obtenidos en estudios previos muestran la relevante participación de la lectina Gal/GalNAc durante el evento de adhesión y daño ocasionado por los trofozoítos de E. histolytica.
Por lo que respecta al posible papel de los anticuerpos y el complemento en el daño de los hepatocitos, al parecer tanto los anticuerpos anti lectina como el complemento no incrementaron el daño de los hepatocitos; sin embargo, es necesario establecer si los anticuerpos dirigidos contra otros epítopos de la lectina pueden evitar la destrucción de los hepatocitos.
Por otro lado, en el bloqueo de la adhesión mediado por carbohidratos, observamos que únicamente la lactosa a concentración de 100mM fue capaz de bloquear de manera significativa el evento de adhesión y, en consecuencia, reducir el daño a los hepatocitos, en tanto que a concentración de 200mM, NAcGal y lactosa bloquearon significativamente la unión de la lectina impidiendo el daño celular, la viabilidad se incrementó en un 80 y 100% respectivamente. Aún cuando se ha mencionado que la adhesión in vitro de la amiba es principalmente inhibida por galactosa y N-acetil-D-galactosamina en el caso del cultivo primario de hepatocitos de hámster NAcGal únicamente bloqueó el evento de adhesión a 200mM, en tanto que lactosa fue capaz de inhibir de manera importante la adhesión, nuestros datos correlacionan con aquellos reportados por Saffer y Petri (42) en donde observan que la lactosa y la N-acetil-lactosamina inhiben casi completamente la adhesión de la amiba a células CHO, estos carbohidratos fueron los inhibidores más potentes incluso que la galactosa durante la adhesión de trofozoítos a células CHO. Así mismo Li y cols (13) compararon la adhesión de trofozoítos con un panel de células CHO mutantes, que presentaban patrones de glicosilación alterados y cuyos resultados mostraron que N-acetil-lactosamina fue el más efectivo; la lactosa a 50mM también inhibió el fenómeno de adhesión. Al interaccionar amibas con monocapas de una línea de células de carcinoma colónico humano (HT-29), N-acetil-lactosamina fue el inhibidor más potente durante la adhesión, ya que concentraciones de 10mM lograron bloquear la adhesión en un 98% (43). Aún cuando se ha mencionado que la Galactosa y N-acetil galactosamina son los carbohidratos más efectivos para bloquear la adhesión hacia los diferentes tipos celulares (11,44,45,5), en el caso del hepatocito que es la célula blanco en el absceso hepático amibiano, la lactosa es mucho más eficiente en bloquear la adhesión de la amiba mediada por la lectina Gal/GalNAc. Las diferencias observadas en la adhesión de la amiba a las diferentes líneas celulares pueden deberse a diferencias en la estructura y expresión de los carbohidratos.
Con todos estos datos podemos sugerir que la lectina de unión a galactosa/N acetil D-galactosamina es una molécula que participa de manera muy importante en la patogénesis del absceso hepático amibiano. Los azúcares lactosa y NAcGal fueron capaces de inhibir el evento de adhesión de la amiba y como consecuencia disminuir el daño en el cultivo primario de hepatocitos de hámster. Nuestros estudios con los anticuerpos anti lectina de 260 kDa mas el complemento al parecer no participan de manera importante en el bloqueo de la adhesión a la célula blanco, estos resultados aunque preliminares deben realizarse con epítopes de la lectina que inhiban el evento de adhesión y por lo tanto eviten la destrucción de los hepatocitos por la lectina.
AGRADECIMIENTOS
Al Sra. Silvia Galindo y Mireya Sánchez Palomero por la asistencia técnica prestada para la realización del presente trabajo.
REFERENCIAS
1. Eaton, R. D., Meerovitch, E., Costerton J. W., “The functional morphology of pathogenicity in Entamoeba histolytica”, Ann Trop Med Par, Inglaterra, vol. 64, pp. 299-304, 1970.
2. García-Rivera, T., et. al., “Aislamiento de clonas de Entamoeba histolytica deficientes en adhesión a eritrocitos humanos”, Arch Invest Med, México, vol. 13, pp. 129-136, 1982.
3. Kobiler, D., Mirelman, D., “Lectin Activity In Entamoeba histolytica trophozoites”,
Infect Immun, Estados Unidos, vol. 29, pp. 221- 225, 1980.
4. Orozco, E. A., et. al., “Las interacciones entre lectina y receptor median la adherencia de Entamoeba histolytica a células epiteliales. Relación de la adhesión con la virulencia de las cepas”, Arch Invest Med, México, vol. 13, pp. 159-167, 1982.
5. Ravdin, J. I., et al., “N-acetyl-D-galactosamine-inhibitable adherence lectin of Entamoeba histolytica. I. Partial purification and relation to amoebic virulence in vitro”, J Infect Dis, Estados Unidos, vol. 151, pp. 804-815, 1985.
6. Petri, W. A., et. al., “Isolation of the Galactose-binding lectin that mediates the in vitro adherence of E. histolytica”, J Clin Invest, Estados Unidos, vol. 80, pp. 1238-1244, 1987.
7. Rosales-Encina, J. L., et. al., “Isolation of a 220-kilodalton protein with lectin properties from a virulent strain of Entamoeba histolytica”, J Infect Dis, Estados Unidos, vol. 156, núm. 5, pp. 790-797, 1987.
8. Meza, I., et. al., "Use of antibodies to characterize a 220-kilodalton surface protein from Entamoeba histolytica", J Infect Dis, Estados Unidos, vol. 156, núm 5, pp. 798-805, 1987.
9. Arroyo, R., Orozco, E., “Localization and identification of an Entamoeba histolytica adhesin”. Mol Biochem Parasitol, Holanda, vol. 23, pp. 151-158, 1987.
10. Rodríguez, M. A., et. al., “Entamoeba histolytica: molecules involved in target cell-parasite relationship”, Mol Biochem Par, Inglaterra, vol. 37, pp.87-100, 1989.
11. Ravdin, J. I., Guerrant, R. L., "The role of adherence in cytopathogenic mechanisms of Entamoeba histolytica. Study with mammalian tissue culture cells and human red blood cells”, J Clin Invest, Estados Unidos, vol. 68, pp.1305-1313, 1981.
12. Cano-Mancera, R., López-Revilla, R., “Inhibition of the adhesion of Entamoeba histolytica trophozoites to human erythrocytes by carbohydrates”, Parasitol. Res, Alemania, vol. 74, pp. 18-22, 1987.
13. Li, E., Becker, A., Stanley, S. L., “Use of chinese hamster ovary cells with altered glycosylation patterns to define the carbohydrate specificity of Entamoeba histolytica adhesion”, J Exp Med, Estados Unidos, vol. 167, pp. 1725-1730, 1988.
14. McCoy, J. J., Mann, B. J., Petri, W. A. Jr., “Adherence and Cytotoxicity of Entamoeba histolytica or How Lectins Let Parasites Stick Around”, Infect Immun, Estados Unidos, vol. 62, núm. 8, pp. 3045-3050, 1994.
15. Maddison, S. E., Kagan, I. G., Norman, G., “Reactivity of human immunoglobulin in amebiasis”, J Immunol, Estados Unidos, vol. 100, pp. 217-226, 1968.
16. Lee, E., Palacios, O., Kretschmer, R., “Localización del anticuerpo antiamibiano en las inmunoglobulinas del suero humano”, Arch Invest Med, México, vol. 1, pp. s101-s106, 1970.
17. Osinsaya, J. D. S., Warhust, D. C., “Specific anti-amoebic immunoglobulins and the cellulose acetate precipitin test in Entamoeba histolytica infection”, Trans Roy Soc Trop Med Hyg, Inglaterra, vol. 74, pp. 605-608, 1980.
18. Harris, W. G., Friedman, M. J., Bray, R. J., “Serial measurement of total and parasite-specific IgE in an African population infected with Entamoeba histolytica”, Trans R Soc Trop Med Hyg, Inglaterra, vol. 72, pp. 427-430, 1978.
19. Revoltella, R., et. al., “Parasite-reactive serum IgE antibodies in African populations relation to intestinal parasite load”, Int Arch Allergy Appl Immunol, Suiza vol. 62, pp. 23-33, 1980.
20. Krupp, I. M., “Antibody response in intestinal and extraintestinal amebiasis”,
Amer J Trop Med Hyg, Inglaterra, vol. 19, pp. 57-62, 1970.
21. Norman, L., Gold, D., Kagan, I. K., “The serologic response of hamsters to experimental liver inoculations with Entamoeba histolytica as measured by indirect hem agglutination test and enzyme linked immunosorbent assay”, Am J Trop Med Hyg, Estados Unidos, vol. 28, pp. 198-205, 1979.
22. Petri, W. A. Jr., Ravdin, J. I., “Protection of gerbils from amebic liver abscess by immunization with the galactose-specific adherence lectin of Entamoeba histolytica”, Infect Immun, Estados Unidos, vol. 59, núm. 1, pp. 97-101, 1991.
23. Kotter y cols, 1997.
24. Pacheco, J., et. al., “In vitro and in vivo interaction of Entamoeba histolytica Gal/GalNAc lectin with various target cells: an immunocytochemical analysis” Parasitol Int, Japon, vol. 53, núm 1, p. 35, 2004.
25. Arias, I., et. al., The liver biology and pathobiology”, segunda ed., Estados Unidos, Editorial Raven Press, pp. 3-683, 1988.
26. Leroy, A., et al., “Contact-dependent transfer of the galactose-specific lectin of Entamoeba histolytica to the lateral surface of enterocytes in culture”, Infect Immun, Estados Unidos, vol. 63, núm. 11, pp. 4253-4260, 1995.
27. Jungery, M., et. al., “A lectin-like receptor is involved in invasion of erythrocytes by Plasmodium falciparum”, Proc Natl Acad Sci, Estados Unidos, vol. 80, pp. 1018-1022, 1983.
28. Snary, D., “Receptors and recognition mechanisms of Trypanosoma cruzi”, Trans Roy Soc Med Hyg, Inglaterra, vol. 79, pp. 587-590, 1985.
29. Lev, B, et. al., “Lectin activation in Giardia lamblia by host protease: a novel host-parasite interaction”, Science, Estados Unidos, vol. 232, pp. 71-73, 1986.
30. Farthing, M. J. G., Pereira, M. E. A., Keusch, G. T., “Description and characterization of a surface lectin from Giardia lamblia”, Infect Immun, Estados Unidos, vol. 51, núm. 2, pp. 661-667, 1986.
31. Ortega-Barria, E., Boothroyd, J. C., “A Toxoplasma lectin-like activity specific for sulfated polysaccharides is involved in host cell infection”, J Biol Chem, Estados Unidos, vol. 274, núm. 3, pp. 1267-1276, 1999.
32. Martínez-Palomo, A., et. al., “Structural basis of the cytolytic mechanisms of
Entamoeba histolytica”, J Protozool, Estados Unidos, vol. 32, pp. 166-175, 1985.
33. Li, E., et. al., “Entamoeba histolytica interactions with polarized human intestinal Caco-2 epithelial cells”, Infect Immun, Estados Unidos, vol. 62, núm. 11, pp. 5112-5119, 1994.
34. Lopéz-Vancell, R., Montfort, I., Pérez-Tamayo, R., “Galactose-specific adhesin and cytotoxicity of Entamoeba histolytica”, Parasitol Res, Alemania, vol. 86, pp. 226-231, 2000.
35. Ravdin, J. I., et al., “Relationship of free intracellular calcium to the cytolytic activity of Entamoeba histolytica”, Infect Immun, Estados Unidos, vol. 56, pp. 1505-1512, 1988.
36. Seydel, K. L., Stanley, Jr. S. L., “Entamoeba histolytica induces host cell death in amebic liver abscess by non-Fas-dependent, non-Tumor Necrosis Factor Alpha-
Rev. del Centro de Inv. (Méx.) Vol. 7. Núm. 25. Ene..- Jun. 2006 31
dependent pathway of apoptosis”, Infect Immun, Estados Unidos, vol. 66, núm. 6, pp. 2980-2983, 1998.
37. Yan, Le., Stanley, Jr. S. L., "Blockade of caspases inhibits amebic liver abscess formation in a mouse model disease”, Infect Immun, Estados Unidos, vol. 69, núm. 12, pp. 7911-7914, 2001.
38. Ragland, B. D., et. al., “Entamoeba histolytica: target cells killed by trophozoites undergo DNA fragmentation which is not blocked by Bcl-2”, Exp Parasitol, Estados Unidos, vol. 79, núm. 3, pp. 460-467, 1994.
39. Petri, W. A. Jr., et. al., “Monoclonal antibodies directed against the galactose- binding lectin of Entamoeba histolytica enhance adherence”, J Immunol, Estados Unidos, vol. 144, núm. 12, pp. 4803-4809, 1990
40. Saffer, L. D., Petri, W. A. Jr., “Role of the galactose lectin of Entamoeba histolytica in adherence-dependent killing of mammalian cells”, Infect Immun, vol. 59, núm. 12, pp. 4681-4683, 1991.
41. Mann, B. J., et. al., “Neutralizing monoclonal antibody epitopes of the Entamoeba histolytica galactose adhesin map to the cysteine-rich extracellular domain of the 170 kilodalton subunit”, Infect Immun, Estados Unidos, vol. 61, núm. 5 pp. 1772-1778, 1993.
42. Saffer, L. D., Petri, W. A. Jr., “Entamoeba histolytica: Recognition of a- and b- galactose by the 260-kDa adherence lectin”, Exp Parasitol, Estados Unidos, vol. 72, pp. 106-108, 1991.
43. Burchard, G. D., Prange, G., Mirelman, D., “Interaction between trophozoites of Entamoeba histolytica and the human intestinal cell line HT-29 in the presence or absence of leukocytes”, Parasitol Res, Alemania, vol. 79, pp. 140-145, 1993.
44. Bracha, R., Mirelman, D., “Adherence and ingestion of Escherichia coli serotype O55 by trophozoites of Entamoeba histolytica”, Infect Immun, Estados Unidos, vol. 40, pp. 882-887, 1983.
45. Bracha, R., Mirelman, D., “Virulence of Entamoeba histolytica trophozoites. Effects of bacteria, microaerophilic conditions, and metronidazole”, J Exp Med, Estados Unidos, vol. 160, pp. 353-368, 1984.