
Carlos Armando Zepeda Velázquez1 y Alfonso Sebastián Lira Rocha2 1Escuela de Ciencias Químicas, Universidad La Salle
E-mail: cazepeda@gmail.com
2Facultad de Química, Universidad Nacional Autónoma de México E-mail: lira@servidor.unam.mx
Recibido: Noviembre 30, 2006. Aceptado: Julio 12, 2007
RESUMEN
La Melatonina (N-acetil-5-metoxitriptamina), producida por la glándula pineal, es uno de los muchos sensores endógenos del cuerpo humano, la cual tiene las siguientes funciones: actúa como mediador de la información fotoperiódica, regula los ritmos circadianos en reptiles, aves y mamíferos incluyendo al hombre (en este último caso su mecanismo de acción no está elucidado), actúa como inductor del sueño en humanos, regula funciones endócrinas, neurofisiológicas y del comportamiento en vertebrados. La melatonina es de interés farmacéutico ya que puede sincronizar los disturbios circadianos como son el “Jet-lag”, los ciclos del sueño, desórdenes estacionales y la depresión invernal.
Se ha propuesto la existencia de varios tipos de receptores a melatonina. Sin embargo, no existen ligandos específicos para cada tipo de receptor. Los estudios encaminados a obtener compuestos con alta especificidad y que puedan funcionar como agonistas o antagonistas han comprendido la síntesis de derivados del indol, de derivados de 2-amidotetralinas, de derivados del naftaleno, de bencimidazoles y de derivados del cromano.
De los modelos teóricos propuestos para la interacción melatonina-sitio receptor se ha postulado que son esenciales el grupo 5-metoxilo y el grupo acetamido, pero también se ha considerado al núcleo indólico como punto importante, debido a que éste puede formar una interacción del tipo transferencia de carga con los residuos de los aminoácidos aromáticos. Lo anterior condujo a Lira et al., a investigar las propiedades electrónicas de diversos derivados de melatonina y su relación con la actividad biológica. Continuando con este estudio, en el presente trabajo se propone la preparación de derivados de melatonina, a los cuales se ha incorporado un sustituyente en la posición 1 del anillo indólico de la melatonina con el fin de modificar sus propiedades electrónicas y que dicha modificación se refleje en sus propiedades biológicas.
Palabras Clave: Melatonina, receptores, indólico, sueño, actividad biológica.
ABSTRACT
The Melatonin (5-methoxy-N-acetyltryptamine), produced by the pineal gland, is one of the many endogenous sensors of the human body, which has the following functions: it acts like mediator of the photoperiodic information, regulates the circadian rhythm in reptiles, birds and mammals including man (in this last case its mechanism of action has not been elucidated), acts as sleep inducer in humans, regulates endocrine functions, neurophysiologic and of the behavior in vertebrates. The melatonin is of pharmaceutical interest since it can synchronize the circadian disturbances as “Jet-lag”, the sleep cycles, seasonal disorders, and winter depression.
The existence of several types of melatonin recipients has been proposed. Nevertheless, they are not specific bounds for each type of receiver. Studies directed to obtain compounds with high specificity and able to work as agonists or antagonists have included the synthesis of derivatives of indol, of 2-amidotetralines derives, of naphthalene derives, of benzimidazoles and cromano derives.
Of the theoretical models proposed for the interaction receiving melatonin-site. It has been postulated that group 5-metoxile and group acetamide are essential, but the indolic nucleus -as important point- has been considered also. The latter can form an interaction of load transference type with the residues of aromatic amino acids. The aforementioned lead Lira et al. to investigate the electronic properties of diverse derivatives of melatonin and their relation with the biological activity. Continuing the study, the aim of this work is to prepare melatonin derivatives, to which a substitute in position 1 of the indolic ring of the melatonin has been incorporated, with the purpose of modifying its electronic properties that such modification is reflected in its biological properties.
Key words: Melatonin, receiver, indolic, sleep, biological activity.
INTRODUCCIÓN:
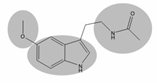
La Melatonina (N-acetil-5-metoxitriptamina), producida por la glándula pineal (GP), es uno de los muchos sensores endógenos del cuerpo humano. Ésta tiene las siguientes funciones: actúa como mediador de la información fotoperiódica [1,2], regula los ritmos circadianos en reptiles, aves y mamíferos incluyendo al hombre (en este último caso su mecanismo de acción no está elucidado), actúa como inductor de sueño en humanos, [3] regula funciones endocrinas, neurofisiológicas y del comportamiento en vertebrados. [3,4,5] La melatonina (fig. 1) es de interés farmacéutico ya que puede sincronizar los disturbios circadianos como son el “Jet-lag” (disturbios del sueño), [6] los ciclos de sueño, [7] los desórdenes estacionales [8] y la depresión invernal [9,10]

Se ha propuesto la existencia de varios tipos de receptores a melatonina (MT1 - MT2,
- MT3). Sin embargo, no existen ligandos específicos para cada tipo de receptor. Los estudios encaminados a obtener compuestos con alta especificidad y que puedan funcionar como agonistas o antagonistas han comprendido la síntesis de derivados del indol, de derivados de 2-amidotetralinas, de derivados del naftaleno, de bencimidazoles y de derivados del cromano.
De los modelos teóricos propuestos para la interacción melatonina-sitio receptor se ha postulado que son esenciales el grupo 5-metoxilo y el grupo acetamido, pero también se ha considerado al núcleo indólico como punto importante, debido a que éste puede formar una interacción del tipo transferencia de carga con los residuos de los aminoácidos aromáticos. Lo anterior condujo a Lira et al. [11] a investigar las propiedades electrónicas de diversos derivados de melatonina y su relación con la actividad biológica. Continuando con este estudio, en el presente trabajo se propone la preparación de derivados de melatonina, a los que se ha incorporado un sustituyente en la posición 1 del anillo indólico de la melatonina, con el fin de modificar sus propiedades electrónicas y que dicha modificación se refleje en sus propiedades biológicas.
ANTECEDENTES
Hace más de 2,500 años, Hipócrates (460-370 a.C.) escribió que la causa de las enfermedades radicaba en los cambios de estación; después, Aristóteles (384-322 a.C.) escribió acerca del papel que desempeña la variación del calor y frío sobre la “bilis negra” y cómo está ligada con la enfermedad. Desde esas épocas se ha buscado una relación entre el cambio de estación y el efecto natural del medio ambiente con las enfermedades, esto llevó, muchos años después, al descubrimiento de la glándula pineal (GP). Los primeros indicios de la existencia de la GP (epífisis cerebri) se remontan a la cultura hindú (2,000 a. C.), en la que se le consideraba como el órgano de la clarividencia. Los griegos creían que su función era regular el flujo del espíritu a través de los ventrículos cerebrales. En el siglo XVIII, Descartes la consideró el “asiento del alma”, esta aseveración influyó para que se considerara a la GP en el plano filosófico-científico hasta el siglo XIX.
En el siglo XX se lograron avances sobre el conocimiento de la GP en donde se descubrió la existencia de melatonina (MEL) por el profesor de dermatología de la universidad de Yale, Aaron B. Lerner en 1958. Su síntesis química permitió establecer de manera inequívoca su estructura en 1959. [12] A la MEL se le han atribuido diversas propiedades como la restauración del sistema inmune, [13] la eficacia contra los daños por radicales libres, [14,15] la prevención de numerosas enfermedades [16,17,18], además de considerársele auxiliar contra el envejecimiento, [19] etc. Actualmente, se investigan diversas propiedades terapéuticas potenciales que se analizarán más adelante.
La hormona melatonina (5-metoxi-N-acetiltriptamina), (N-[2-(5-Metoxi-1H-indol-3- yl)etil]acetamida) es sintetizada principalmente por la GP, y en tejidos extrapineales como la retina y el tracto gastrointestinal pero en menor proporción. La GP está localizada en el centro del sistema nervioso central (SNC) de mamíferos y está relacionada con otras estructuras como la retina, el hipotálamo y el sistema nervioso autónomo (SNA) en el control de la secreción de esta hormona [20]. Su biosíntesis está directamente ligada a la secreción, ambas inician después del ocaso, continúan durante la noche y finalizan después del amanecer. Este patrón de secreción es de naturaleza circadiana (un periodo de aproximadamente 24 horas) y depende en última estancia del principal reloj biológico que reside en el núcleo supraquiasmático (NSQ) de los mamíferos.
La MEL es una indolamina endógena que tiene como precursor a la serotonina, que es a su vez un metabolito del triptófano. [21,22]
En algunos mamíferos, la luz actúa directamente sobre la GP inhibiendo la producción de MEL, que es usualmente producida en ausencia de luz, [23] a excepción del humano, ya que en éste el sistema de producción de MEL es más complicado.
La luz entra al ojo y viaja a través de dos vías principales: el tracto retino- hipotalámico (TRH) y el prospecto intergenicular (IGL).
En los fotorreceptores de la retina, células ganglio retinales y trayectos retino- neuronales se inicia el TRH [24]. Aún en ausencia de la mayoría de estos fotorreceptores, se lleva a cabo la señalización. La información alcanza a un subtipo específico de célula ganglionar y la proyecta al nervio óptico, donde dos tercios de la proyección la atraviesan. Esta señalización eventualmente hará sinapsis sobre el NSQ u otra estructura hipotalámica, el proceso de sinapsis es aún desconocido.
La señal vía IGL es proyectada a través del tracto geniculohipotalámico (TGH), al igual que el TRH, éste hace sinapsis sobre el NSQ, el IGL probablemente debe tener funciones relacionadas con una reseñalización responsable de los estímulos de larga duración, [25] pero esto no se ha demostrado.
En adición al TRH y IGL/ TGH existe otro camino de señalización al NSQ. La información es llevada vía neuronas serotoninérgicas localizadas en el cerebro medio, [25] pero no se ha realizado el estudio adecuado de esta ruta, por tanto la relación entre la serotonina y la señalización es incierta.
El NSQ proyecta la información al núcleo paraventricular (NPV), lo que ha sido demostrado por Kalsbeek et al. [26] quienes propusieron que esta ruta es principalmente de tipo GABAérgico. El NPV proyecta la información al paquete de neuronas del cerebro frontal medio; estas neuronas inician la formación reticular, (un generador activo de vigilancia del sueño), que hace sinapsis sobre la columna intermediolateral medular del cordón espinal superior (CIL). Estas células se conectan al ganglio cervical superior (GCS), la señal llega a la GP vía receptores α2, que a través de la norepinefrina (noradrenalina), activa a los receptores α1 y β1. Esto induce la producción de la N- acetiltransferasa (NAT). La conversión de la serotonina (5-hidroxitriptamina) a N- acetilserotonina por NAT, es el factor limitante en la producción de MEL. [27]
La serotonina (5-HT) proviene del aminoácido triptófano que es captado por los pinealocitos, éste es oxidado en la posición 5 del anillo indólico por la acción de la triptófano hidroxilasa [28] para formar el 5-hidroxitriptofano, el que es descarboxilado por acción de la descarboxilasa de L-aminoácidos aromáticos y forma la 5-HT. [29]
La 5-HT sigue, por una parte, la ruta catabólica para formar diversos metoxindoles como son el ácido 5-metoxi-indol acético y 5-metoxi-triptofol y por otra, la formación de MEL. En esta última vía, como ya se mencionó, la 5-HT es acetilada en el nitrógeno de la etilamina por la acción de la enzima NAT [30] para formar la N-acetilserotonina, la que es a su vez O-metilada por efecto de la enzima hidroxiindol-O-metil-transferasa (HIOMT); esta enzima está presente en el citoplasma de las células parenquimatosas de la GP y transfiere el grupo metilo activo de la S-adenosil metionina al grupo hidroxilo de la posición 5 del núcleo indólico para formar la N-acetil-5-metoxitriptamina o MEL.[31] El sistema se muestra en la figura 2.

La luz entra a través de la retina hacia el núcleo supraquiasmático (NSQ) vía el tracto retino-hipotalámico (TRH) o el prospecto intergenicular (IGL) y el tracto geniculohipotalámico (TGH), hacia el núcleo paraventricular
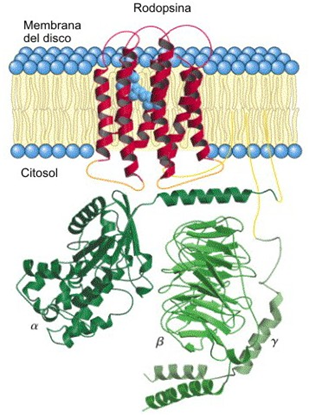
El mecanismo de fototransducción en vertebrados inicia con la iluminación que activa la molécula rodopsina (fig. 3), ésta transforma el 11-cis-retinal en 11-trans-retinal, esto provoca una modificación de la conformación de toda la molécula de rodopsina, lo que induce la activación de la subunidad alfa de transducción (Tα) que cambia de difosfato de guanosina (GDP) a trifosfato de guanosina (GTP). Ésta induce la disociación de la subunidad β-γ. La Tα activada se une y activa a la monofosfato cíclico de guanosina (GMPc) fosfodiesterasa, la cual provoca una disminución en los niveles de GMPc, lo que abre el canal catiónico de la membrana externa del pinealocito durante la fase de oscuridad. La iluminación incrementa la posibilidad de que el canal permanezca cerrado (fig. 4).
La corriente que se produce durante las condiciones de oscuridad es debida en un 80% a la entrada de iones sodio, sin embargo el canal también es permeable para los iones de calcio y magnesio [32]. Además, en la fase de oscuridad debe existir un mecanismo para eliminar tanto el calcio como el exceso de sodio. Este mecanismo parece consistir en un intercambiador sodio/calcio al nivel de la membrana de los segmentos externos, además, el calcio tiene un papel importante en todo el proceso de la fototransducción, ya que, aunque no participa directamente en la cascada de la fototransducción, mejora la capacidad de los bastones para recuperarse después de la iluminación, teniendo un importante papel regulador en los fenómenos de adaptación a las condiciones de luz/oscuridad.
(NPV), hacia las neuronas del cerebro frontal medio, a la formación reticular, que hace sinapsis sobre la columna intermediolateral medular del cordón espinal superior (CIL), al ganglio cervical superior (GCS), activa a los receptores α1 y β1, esto induce la liberación de N-acetiltransferasa (NAT). El triptófano se metaboliza a serotonina, que a través de NAT, metaboliza a N-acetilserotonina, la cual es la precursora de la MEL.

La MEL circulante tiene una vida media de 10-40 minutos [33] ya que en el hígado se hidroxila a 6-hidroximelatonina, que posteriormente es excretada libre o conjugada con ácido glucurónico o con sulfato (6-sulfatoximelatonina), este ultimo compuesto sirve como trazador en la medición de la hormona y de su ritmo circadiano. [34]
También se ha determinado la presencia de MEL en el tracto gastrointestinal [35] y al parecer está asociada a funciones endócrinas, parácrinas y autócrinas, así como al sistema inmune y la actividad muscular. La periodicidad de la producción de la MEL gastrointestinal debe estar relacionada con la ingesta alimenticia más que con la exposición a la luz.
La MEL puede afectar un gran número de procesos al ser liberada en la corriente sanguínea. Las funciones biológicas y los procesos que pueden ser afectados por la MEL son mencionados en la tabla 1. [36]
Función o Proceso Efecto Mecanismo Propuesto
Sueño Efecto hipnótico e incremento en la propensión al sueño
Ritmo circadiano Control del ritmo circadiano y
acción en el ciclo luz-oscuridad
Humor Posible acción en desordenes del
humor como es el (TEA y SFSR)
Acción mediada en el receptor del sistema límbico Secreción de melatonina en respuesta a un impulso neuronal de la retina y del NSQ; Termorregulación Desconocido
Maduración sexual y reproducción
Inhibición del proceso de reproducción
Inhibición del eje hipotálamo- pituitaria-gónadas; efecto sobre la esteroidogenesis de ovarios
1 La luz activa la rodopsina, la subunidad alfa de transducción (Tα) se activa por cambio de GDP a GTP, se disocian las subunidades β-γ de ésta, esto induce la activación del guanosina monofosfato cíclico (GMPc), lo cual permite la apertura del canal catiónico.
Cáncer Efectos antiproliferativos Secuestro de radicales libres
y posible aumento en la respuesta inmune
Respuesta inmune Aumenta la respuesta inmune Incremento en la producción
de interleuquinas
Envejecimiento Posible efecto de protección y
Secuestro de radicales libres
decaimiento de muerte celular
La MEL existe en pequeñas cantidades en muchas especies de plantas, incluyendo la avena, el maíz dulce, el arroz, el jengibre, los tomates, los plátanos y la cebada. La ingestión de otros alimentos como son las algas marinas, el fríjol de soya, las semillas de calabaza, las semillas de sandía, las almendras, el cacahuate, la levadura, la malta, el pollo, el queso “cottage”, el yogurt y la leche, ayuda a incrementar la producción de MEL en el cuerpo ya que estos alimentos son ricos en triptófano, el cual, como ya se mencionó, es el aminoácido esencial a partir del cual se metaboliza la MEL.
Trastornos del Tiempo y el Jet-Lag
El Jet-Lag es el resultado de viajes de larga distancia que cruzan varios husos horarios en un corto periodo de tiempo. Síntomas como disturbios del sueño, pérdida de apetito, reducción de la eficiencia psicomotora y malestar general, están relacionados con este fenómeno.
El problema se ha tratado de resolver utilizando sincronizadores o zeitgebers (del alemán “dadores de tiempo”), que son factores ambientales que ayudan al organismo a mantenerse en fase. El viajar de una manera rápida y cruzar varios husos horarios altera el ritmo normal del cuerpo, se ha observado que el cuerpo se adapta de una mejor manera a estos viajes si se realizan hacia el oeste, esto se explica porque el día es más largo y éste se adapta mejor a nuestro reloj biológico que es de aproximadamente 25 horas. Los ritmos circadianos necesitan aproximadamente un día para adaptarse a cada huso horario cruzado. En otras palabras 3 horas de diferencia de tiempo requerirán 3 días de adaptación aproximadamente. [36] La MEL ha sido utilizada como un zeitgeber para disminuir el tiempo de recuperación al Jet-lag.
El trastorno estacional afectivo (TEA), conocido también como depresión invernal, es considerado un subtipo clínico de una depresión mayor y afecta principalmente a habitantes de países pertenecientes al hemisferio norte, donde el periodo de luz es menor en el invierno. Actualmente, uno de los principales tratamientos contra el TEA, es el uso de la fototerapia, ya que estudios previos han mostrado su efectividad. El TEA y la terapia con luz fueron identificados por estudios básicos del ritmo circadiano y estacional en animales. Como ya se ha mencionado, muchos ritmos estaciónales son mediados a través de cambios en la secreción de MEL, la cual es regulada por el reloj circadiano endógeno y puede ser suprimida por la exposición a la luz, por esta razón se cree que existe una relación entre el TEA y la MEL, aunque este trastorno está relacionado de una igual forma a desórdenes psicológicos, fallas en la secreción de algún neurotransmisor o hasta por factores genéticos, entre otros. Actualmente se realizan mayores esfuerzos en el estudio de este trastorno, para determinar su causa principal y encontrar una terapia adecuada. [10]
El síndrome de fase de sueño retardada (SFSR) es una causa común del insomnio severo, que se le caracteriza por una dificultad para dormir y la incapacidad de hacerlo en horas socialmente aceptables; si una persona con SFSR se acuesta a las 11:00 p.m. no se dormirá hasta que el cuerpo esté listo. Usualmente, estos individuos entran en fase de
sueño hasta las 3:00 o 4:00 a.m.; el SFSR podría deberse a una desregulación del ritmo circadiano del ciclo sueño vigilia. Un estudio realizado recientemente mostró que la administración oral de MEL diminuye el SFSR. [37]
Se ha propuesto que las proteínas β-amiloides (Aβ), juegan un papel central en la neurodegeneración observada en la enfermedad del Alzheimer. Algunas propiedades patológicas de estas proteínas son la neurotoxicicidad y la resistencia a la degradación proteolítica, éstas dependen de la habilidad de Aβ de formar estructuras β o fibrillas amiloides. Se ha reportado que la MEL interactúa sobre Aβ1-40 y Aβ1-42 e inhibe la formación progresiva de estructuras β y fibrillas amiloides, por tanto MEL constituye un posible agente terapéutico en la enfermedad de Alzheimer. [38]
Los radicales libres son moléculas que tienen un par de electrones desapareados, si un electrón es adicionado a O2 entonces se forma el radical superóxido O2¯, éste es reducido por la superóxido dismutasa a H2O2 que es tóxico a altas concentraciones y puede ser reducido a ˙OH. El radical hidroxilo (˙OH) daña a las células. La MEL es probablemente un neutralizador de ˙OH. [14]
Una de las principales causas relacionadas con el proceso de destrucción del tejido neuronal son los radicales libres, que son el resultado natural del metabolismo aerobio. El cerebro es particularmente susceptible al ataque de los radicales libres. [14,15] Los antioxidantes vitamínicos como son la vitamina E (principalmente el alfa-tocoferol) y la vitamina C (ascorbato) ayudan a proteger al cerebro del estrés oxidativo por secuestro directo de radicales libres. La MEL también es utilizada por el cerebro para su protección, pero el mecanismo de acción de ésta no se ha elucidado. La MEL ha sido probada In Vitro comparándola contra la vitamina E y en algunos casos ha mostrado mayor actividad en la neutralización del radical peróxido, pero en los últimos años ha existido una discrepancia sobre estos resultados. [40]
Además, la MEL promueve la actividad de la principal enzima antioxidante del cerebro, la glutation peroxidasa, lo que contribuye a reducir el daño producido por el metabolismo oxidativo. Los estudios In Vivo han sido contradictorios sobre esta actividad pero se requieren más de estos para comprobar la actividad antioxidante de la MEL. [40]
Como ya se mencionó la MEL es un “agente secuestrador” (scavenger) de los radicales libres, protege no sólo a las células neuronales sino también a diversas macromoléculas y al ácido desoxirribonucleico (ADN), lo que podría ser un factor determinante en el ritmo de envejecimiento. [14]
Los campos electromagnéticos (CEM) han sido relacionados con gliomas ya que, al someter una rata a un CEM, ésta desarrolla un tumor, principalmente un glioma, si la glándula pineal es removida del cerebro de una rata y es sometida al CEM, la incidencia de gliomas aumenta. [16] Una inhibición del crecimiento del cáncer se ha observado al utilizar MEL; existen datos que indican que la MEL es antagónica a los efectos de los estrógenos. [17] La inhibición de los agentes antioxidantes por agentes reductores como el glutation elimina la actividad oncostática de MEL en algunas líneas celulares de cáncer de mama humano.
La inmunidad celular frente a los tumores puede potenciarse expresando coestimuladores y citoquinas en las células tumorales y tratando a los pacientes portadores de tumores con citoquinas que estimulen la proliferación y la diferenciación de los linfocitos T y las células citocidas naturales (NK). Las citoquinas se pueden administrar por vía sistémica para el tratamiento de diversos tumores humanos. Este tipo de terapia experimental se hizo factible cuando se dispuso de preparaciones puras de citoquinas en cantidades suficientes. La experiencia clínica más amplia corresponde a la IL-2, administrada en dosis elevadas. Después de la administración de IL-2, aumenta el número de linfocitos sanguíneos y de células NK, aumenta la actividad de las células NK y amplifican en el suero el factor de necrosis tumoral (TNF), la interleuquina 1 (IL-1) y el interferón γ (IFN-γ). Cabe suponer que la IL-2 actúa estimulando la proliferación y la actividad antitumoral de las células NK y de los linfocitos T citotóxicos (CTL). La IL-2 ha sido eficaz en la inducción de respuestas medibles de regresión tumoral en aproximadamente el 10% de enfermos con melanoma y carcinoma de células renales avanzados, y actualmente es un tratamiento aprobado para estos cánceres. La MEL debe aumentar la actividad antitumoral de la interleuquina 2 (IL-2) por inhibición del factor de crecimiento tumoral. Un estudio piloto fue realizado utilizando una dosis baja de IL-2 combinada con MEL en 14 pacientes que tenían tumores endócrinos y cuyos tratamientos anteriores no habían sido eficaces; los resultados mostraron que la terapia de IL-2 junto con la MEL es tolerada por los pacientes con los tumores antes mencionados sumado al bajo costo de este tratamiento. Tres de estos catorce pacientes mostraron una regresión en el crecimiento del tumor. Esto es importante ya que la terapia de IL-2 en altas dosis, es tóxica, provoca fiebre, edema pulmonar y shock vascular. [18]
La MEL ha sido relacionada en la regulación del metabolismo del calcio y del fósforo por estimular la glándula paratiroides e inhibiendo la liberación de calcitonina y la síntesis de prostaglandinas. La menopausia está asociada con un decaimiento en la secreción de MEL y un incremento en la calcificación pineal. [41]
La GP ha sido relacionada con el sistema inmune y la inmunodepresión, esta última ha sido tratada con el uso de la MEL. El timo es uno de los principales blancos de la MEL y sus efectos inmunoestimulantes pueden ser mediados por derivados de las células T colaboradoras, lipoquinas y posiblemente hormonas pituitarias. Las lipoquinas como el IFN-γ, y la IL-2 así como las hormonas tímicas pueden modular la síntesis de la MEL en la GP. [13]
La relación entre la GP y la pubertad ha sido especulada durante muchos años. Es conocido que la GP comienza a acumular calcio después de la pubertad, aunque ello no influye en su actividad, esto debido a que la enzima HIOMT se mantiene intacta desde el inicio de la juventud hasta edades avanzadas. La pubertad precoz que suele darse cuando existen tumores originados en el parénquima de la GP, da lugar a un adelanto de la pubertad y se ha demostrado un aumento en la concentración de la HIOMT en los pacientes con pubertad precoz. Esto es el motivo de que la GP pueda influir en el desarrollo prematuro de la pubertad y la función sexual. [42] También se ha demostrado que en la amenorrea hipotalámica existe una alteración en los niveles de MEL. [43]
La MEL puede producir mareos, fatiga, cefalea, confusión, disminución de la temperatura corporal y disforia en pacientes depresivos.
Se han observado las siguientes reacciones adversas:
· Cardiovasculares: se ha reportado la producción de taquicardia por MEL, aunque la relación causa-efecto es dudosa. [44]
· SNC: sedación, modorra y fatiga son efectos frecuentes. [44,45,46]
· Cefalea y confusión: pueden ocurrir ocasionalmente; en pacientes con depresión mayor, la MEL ha producido disforia y pérdida del sueño. [44,47].
· Piel: se ha reportado prurito en uno de cada 12 pacientes geriátricos con insomnio. La imputabilidad del fármaco es dudosa. [48]
· Se han reportado numerosos efectos adversos durante la terapia combinada de melatonina/IL-2 en el tratamiento del cáncer, incluyendo fiebre, vómitos y rash; aunque los efectos pueden ser atribuidos a la IL-2. [49]
Como se puede apreciar la MEL presenta diversas actividades fisiológicas y sus posibles aplicaciones terapéuticas son amplias; sin embargo, la MEL tiene el inconveniente de ser metabolizada rápidamente por lo cual no se puede emplear como agente terapéutico eficaz. Otro inconveniente es que no existen sustancias que sean selectivas hacia los diferentes tipos de receptores de la MEL.
En este sentido se han realizado estudios para hallar sustancias que permitan determinar los sitios de los diferentes subtipos de receptores MT1, MT2 y MT3. Las variantes estructurales han sido diversas tales como la incorporación de un átomo de halógeno, un grupo metilo o un grupo fenilo en la posición 2 de la estructura de la MEL. También se ha cambiado el anillo indólico por un anillo naftalénico o un anillo de benzofurano o de benzotiofeno (fig. 5). [50]

Los puntos farmacofóricos importantes que se han mantenido constantes son el grupo metoxilo en la posición 5 del anillo indólico y el grupo acetamido de la cadena lateral en la posición 3. Otro punto farmacofórico es el anillo indólico. La razón por la cual se mantienen estos puntos farmacóforos es que, el grupo 5-metoxilo es responsable de la afinidad al sitio receptor y el grupo acetamido es responsable de la actividad biológica, mientras que el anillo aromático coadyuva a la fijación del sitio receptor. Los puntos farmacofóricos importantes se indican en la figura 6.
Sitios de Unión de Melatonina
A finales de 1970 el sitio de unión de la MEL fue determinado utilizando el radioligando [3H]-melatonina [13,44], el cual es de baja especificidad; después fue remplazado por el radioligando 2 [125I]-yodomelatonina que mostró una mayor especificidad [51] y es el que actualmente se usa. La primera clasificación de los supuestos receptores de MEL en los
tipos ML1 y ML2 se basó en las diferencias cinéticas y farmacológicas de unión de la 2 [125I]-yodomelatonina. Estudios de clonación revelaron dos receptores recombinantes de MEL, Mel1a y Mel2a, actualmente llamados MT1 y MT2; utilizando 2 [125I]-yodomelatonina, estos receptores mostraron la misma farmacología general que los ML1 y fueron definidos como entidades únicas con base en su estructura molecular y su localización
cromosomal. Posteriormente se caracterizó un tercer tipo de receptor de melatonina que se denominó MT3, el cual es una quinona reductasa de tipo II (QR2) y está localizado principalmente en los cerebros de hámsteres. Al contrario de los receptores MT1 y MT2 que muestran una alta afinidad de unión a MEL (Kd MT1 = 26-56 pM; Kd MT2 = 160 pM), [52] la del receptor MT3 es menor (Kd MT3 = 1.48 nM), por tanto corresponde a un sitio de baja afinidad.
Los receptores MT1 y MT2 están acoplados a proteína G y en concentraciones bajas (1-10 picomolar), llevando a una disminución en la actividad de la adenilato ciclasa (fig. 7), mientras que la activación de MT3 inicia la hidrólisis del fosfatidilinositol.
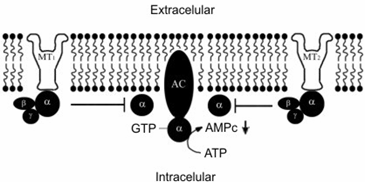
Receptores MT1
Muchos agonistas y antagonistas no selectivos del receptor de MEL han sido identificados, estos compuestos han sido utilizados en la caracterización farmacológica de los receptores de MEL en tejidos nativos (pars tuberalis de oveja, cerebro y arteria caudal de rata). [52]
Como ya se mencionó, la transducción del receptor MT1 es vía la inhibición de la adenilato ciclasa, posiblemente por la estimulación del fosfato de inositol en sistemas recombinantes y estimulación de la acumulación del Ca+2 intracelular. La caracterización de los receptores MT1 mediante señalización en tejidos nativos no ha sido reportada. [52]
Los receptores MT1 se encuentran distribuidos en NSQ, pars tuberalis, NPV, cerebelo, hipotálamo, riñón, corteza occipital, corteza parietal, corteza temporal, corteza frontal y tálamo (humanos). [52,53]
Recientemente, un número de agonistas y antagonistas parciales selectivos del receptor MT2 han sido identificados. La activación de los receptores recombinantes de MEL (humana) inhibe la formación de AMPc y GMPc.
La expresión del receptor MT2 por reacción inversa en la cadena de polimerasa RT- PCR (RT-PCR, del inglés reverse transcription polymerase chain reaction) e hibridación in situ en mamíferos sugiere que este receptor puede expresarse en la retina de mamíferos, en áreas selectas del cerebro y en algunos canales arteriales. [52]
La existencia de un antagonista del receptor MT2 ha llevado a la identificación de receptores funcionales MT2 en la retina (inhibición de la liberación de dopamina), en la sincronización del sistema circadiano y en la arteria caudal en ratas (vasodilatación). [52]
Agonistas y antagonistas no selectivos del receptor de MEL han sido identificados, éstos han sido utilizados en la caracterización farmacológica de los receptores de MEL en tejidos nativos de hámster, pero los sitios MT3 muestran un perfil farmacológico diferente a los receptores MT1 y MT2.
A un nivel funcional, los receptores MT3 parecen señalizar a través de un incremento en la activación del fosfoinositol. El receptor se encuentra localizado principalmente en el cerebro de hámster e hígado humano. [52,54]
De los modelos teóricos propuestos para la interacción melatonina-sitio receptor se ha postulado que son esenciales el grupo 5-metoxilo y el grupo acetamido, pero también se ha considerado al núcleo indólico como punto importante, debido a que éste puede formar una interacción del tipo transferencia de carga con los residuos de los aminoácidos aromáticos del sitio receptor. [11]
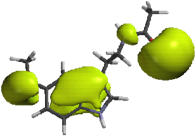
Lira et al. [11] investigaron las propiedades electrónicas de diversos derivados de MEL y su relación con la actividad biológica, en particular su afinidad a los receptores de la MEL; su intención fue modificar las propiedades electrónicas sobre el núcleo indólico de la MEL. Inicialmente determinaron las zonas de mayor densidad de carga en la estructura de la MEL, en especial calcularon el potencial molecular electrostático (PME). Los resultados indicaron que existen tres zonas con alta densidad de carga; una localizada sobre el grupo 5-metoxilo, otra sobre el átomo de oxígeno del grupo acetamido y una tercera que comprende al anillo indólico. La zona aromática está compuesta por un lóbulo superior (región A) y un lóbulo inferior (región B) de proporciones similares, ubicados en ambas caras del núcleo indólico (fig. 8). Estos lóbulos abarcan los átomos N1, C3, C3a, C4 y C7a.
Posteriormente, incorporaron en la posición 1 del anillo indólico grupos bencilo, benzoilo y fenilo sustituidos en posición “para” con grupos tales como –NO2, -OCH3, etc., realizando un estudio de sus propiedades electrónicas de manera similar a la MEL.
Al comparar las regiones A y B de la MEL, con las mismas regiones obtenidas de los compuestos 1a (1-N-bencilmelatonina), 1b (1-N-fenilmelatonina) y 1c (1-N- benzoilmelatonina), se observa una disminución significativa en el caso del sustituyente benzoilo (1c), también, se observó que el sustituyente bencilo (1a) muestra un incremento en el volumen de estas regiones (fig. 9).
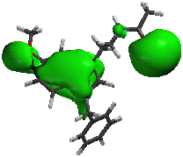 1a
1a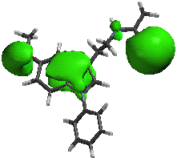 1b
1b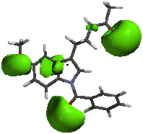 1c
1cLa comparación de las regiones A y B de la MEL contra las mismas regiones de la serie “a”, permite observar que el sustituyente bencilo (1a) y el p-metoxibencilo (2a) incrementan el volumen de estas regiones. Para el caso de la serie “b”, se observó que las regiones A y B con el sustituyente p-nitrofenilo (5b) desaparecen totalmente, en el caso de la serie “c” al igual que la serie “b” las regiones A y B con el sustituyente p- nitrobenzoilo (5c) desaparecen (fig. 10).
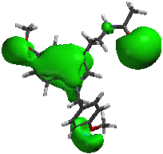 2a
2a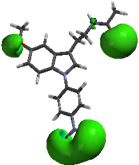 5b
5b 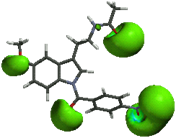 5c
5c
Como regla, se observó que un sustituyente con un grupo nitro siempre disminuye la región A y B para todas las series, por lo que se esperaría, a priori, una menor actividad biológica de los derivados nitrados, ya que aquellos compuestos que mantengan el volumen de las regiones A y B, tendrán una actividad biológica parecida a la MEL y los que presenten una disminución en estas regiones presentarán una actividad biológica o una afinidad menor a los sitios receptores de la MEL. Con esta premisa Lira et al. propusieron un estudio en el que se cuantificó la afinidad de la MEL y de los análogos propuestos. Los compuestos obtenidos y sus datos de afinidad se muestran en la tabla 2.

Compuestos R (Ki, nM)
MEL |
H |
0.82 |
1a |
-CH2-C6H5 |
1640 |
2a |
-CH2-C6H4-p-OCH3 |
737 |
3a |
-CH2-C6H4-p-CH3 |
738 |
4a |
-CH2-C6H4-p-F |
3290 |
1b |
-C6H5 |
60.4 |
2b |
-C6H4-p-OCH3 |
52.6 |
3b |
-C6H4-p-CH3 |
3020 |
4b |
-C6H4-p-F |
748 |
5b |
-C6H4-p-NO2 |
408 |
1c |
-CO-C6H5 |
538 |
2c |
-CO-C6H4-OCH3 |
1090 |
3c |
-CO-C6H4-CH3 |
477 |
4c |
-CO-C6H4-F |
423 |
5c -CO-C6H4-NO2 82.4
Con respecto a los valores de las constantes de disociación para los análogos de MEL, se observa que la incorporación de un grupo voluminoso en la posición 1 del anillo del indol muestra una disminución en la afinidad. Aunque esto es variable para cada serie.
La comparación entre los valores de 1a, 1b y 1c indica que el grupo fenilo muestra una mayor afinidad. Este comportamiento está de acuerdo a lo pronosticado. Sin embargo, la explicación para el valor del compuesto 1a se atribuye a un posible impedimento estérico por parte del grupo bencilo.
En el caso de la serie “a”, los compuestos que poseían un grupo electrodonador incrementaron la afinidad (compuestos 2a y 3a); para la serie “b” se observó que la incorporación de un grupo metoxilo (compuesto 2b) mejora la afinidad en comparación con el compuesto 1b. Una situación similar sucede al comparar los compuestos 2a y 1a.
Este fenómeno no sucede para los compuestos de la serie “c”, en la que, por el contrario, el compuesto con el grupo electroatractor (compuesto 5c) mostró el mejor valor de afinidad.
Lira et al. concluyeron que no sólo la presencia de un grupo voluminoso es necesaria, sino que también la presencia de un grupo polar es determinante. Una posible explicación de esto es que exista una interacción entre el grupo polar y los residuos de aminoácidos del receptor. [11]
Tomando en consideración los hallazgos anteriormente mostrados, se propuso continuar con la síntesis de derivados 1-N-sustituidos de MEL, ya que se deseaba corroborar que la presencia de un grupo voluminoso, la presencia de un grupo polar o la presencia de un grupo electroatractor, muestra una influencia en su afinidad al sitio receptor de la MEL.
Dada la afinidad del compuesto “5c” reportado por Lira et al. se propuso la síntesis de un compuesto similar que mantenga las propiedades de un grupo electroatractor y polar, el compuesto propuesto es 1-N-(4-cianobenzoil)melatonina y sus demás análogos, los cuales pretenden disminuir el volumen de PME en las regiones A y B de MEL, pero en un menor grado en comparación a los compuestos con un grupo nitro.
También se propuso la síntesis de derivados que posean un átomo de cloro siguiendo el mismo patrón que los derivados desarrollados por Lira et al., con el fin de contribuir al establecimiento de los requerimientos estructurales responsables de la unión al sitio receptor de la MEL.
OBJETIVOS
Sintetizar y caracterizar análogos 1-N-sustituidos de Melatonina (5-metoxi-N- acetiltriptamina).
a) Sintetizar los derivados propuestos:
1. 1-N-(4-cianobenzil)melatonina (I)
2. 1-N-(4-cianobenzoil)melatonina (II)
3. 1-N-(4-cianofenil)melatonina (III)
4. 1-N-(4-clorobenzil)melatonina (IV)
5. 1-N-(4-clorobenzoil)melatonina (V)
6. 1-N-(4-clorofenil)melatonina (VI)
b) Caracterizar los derivados obtenidos mediante sus constantes físicas y propiedades espectroscópicas (Infrarrojo, Resonancia Magnética Nuclear) y Espectrometría de Masas.
COMPUESTOS PROPUESTOS

(a): THF/NaH/α-bromo-p-toluenitrilo
(b): THF/NaH/cloruro de 4-cianobonzoilo (c): THF/NaH/α,4-diclorotolueno
(d): THF/NaH/cloruro de 4-clorobenzoilo

(e): DMF/CuI/K2CO3/p-yodo-benzonitrilo (IIIb)/4 h/↑↓.
(f): DMF/CuI/K2CO3/1-cloro-4-iodobenzeno/4 h/↑↓.
CONCLUSIONES
1-N-(4-clorofenil)melatonina (VI)
Con base en los datos espectroscópicos y sus constantes físicas de los compuestos sintetizados, puede decirse que los siguientes compuestos fueron obtenidos:
1. 1-N-(4-cianobenzil)melatonina (I)
2. 1-N-(4-cianobenzoil)melatonina (II)
3. 1-N-(4-cianofenil)melatonina (III)
4. 1-N-(4-clorobenzil)melatonina (IV)
5. 1-N-(4-clorobenzoil)melatonina (V)
6. 1-N-(4-clorofenil)melatonina (VI)
Los derivados del 5-metoxi-N-acetiltriptamina propuestos se obtuvieron de una manera pura y fue caracterizada su estructura por evidencias espectroscópicas (Infrarrojo, Resonancia Magnética Nuclear) y Espectrometría de Masas.
Los rendimientos obtenidos se muestran en la tabla 3:
Compuesto Rendimiento
1-N-(4-cianobenzil)melatonina (I) |
41.20 % |
1-N-(4-cianobenzoil)melatonina (II) |
34.09 % |
1-N-(4-cianofenil)melatonina (III) |
20.93 % |
1-N-(4-clorobenzil)melatonina (IV) |
53.43 % |
1-N-(4-clorobenzoil)melatonina (V) |
37.16 % |
1-N-(4-clorofenil)melatonina (VI) 48.42 %
La ruta de purificación empleada para los compuestos: 1-N-(4-clorobenzil)melatonina (IV), 1-N-(4-clorobenzoil)melatonina (V) y 1-N-(4-clorofenil)melatonina (VI), fue modificada para obtener un incremento en el promedio de los rendimientos de 14.26% con respecto de los demás compuestos, lo cual nos indica que se deben realizar mayores modificaciones en la purificación para aumentar los rendimientos.
Resta por determinar la constante de afinidad de los compuestos obtenidos en el presente estudio.
1, Trabajo ganador de la Medalla “Hno. Salvador González 2006”, Nivel: Licenciatura, Categoría: Avanzada, Áreas Multidisciplinarias: Ciencias Naturales y Exactas, XIlI Jornadas de Investigación, Universidad La Salle, Mayo 2006.
2 Proteínas G proteínas que unen a guanil nucleótidos y cuya función es el intercambio de moléculas catalizando la sustitución de difosfato de guanosina (GDP) unido por trifosfato de guanosina (GTP). Las proteínas G con GTP unido activan a diversas enzimas celulares en diferentes cascadas de señalización. Las proteínas triméricas de unión al GTP se asocian a las porciones citoplásmicas de muchos receptores de la superficie celular.
3 Se observa el volumen de PME en las regiones A y B.
REFERENCIAS
[1] Carter, D. S. and Goldman, B. D. (1983). Endocrinology, 113, 1261-1267.
[2] Bittman, E. L., Karsch, F. J. (1984). Biol. Reprod, 30, 585-593.
[3] Underwood, H., Goldman B.D. (1987). J. Biol. Rhytms, 2, 279.
[4] Cassone, V. M. (1990). Trends Neurosci, 13, 457.
[5] Krause, D. L., Dubocovich M. L. (1991). Annu Rev Pharmcol Toxicol, 31, 549.
[6] Petrie, K., Conagle J. V., Thompsom L., Chamberlain, K. (1989). Br Med J, 298, 707. [7] Wher, T. A., J. (1991). Clin Endocrinol Metab, 73, 1276.
[8] Guardiola-Lemaitre, B Adv Pineal Res. P. 351.
[9] Wetterberg L., Beck-Friis J., Kielmann B. F. (1990). Biological Rhythms Mood Disorders, Light Therapy and the Pineal Gland, American Psychiatric: Washington, 69.
[10] Lam. R., Levitan R. (2000). Psychiatry Neurosci, 25(5), 469-480.
[11] Lira R. A., Espejo G. O., Naranjo R. E. (2002). European Journal of Medicinal Chemistry, 37, 945-951.
[12] Szmuszkoviz et al. (1960). J. Org. Chem, 25, 857.
[13] Maestroni G. J. (1993). Journal of Pineal Research, 14(1), 1-10.
[14] Reiter R. J. et al. (1993). Journal of pineal research, 18(1), 1-11.
[15] Reiter R. J. (1995). FASEB Journal, 9(7), 526-533.
[16] Hughes J.T. (1994). Carcinogenesis and Mutagenesis, 14(5), 213-217.
[17] Webb S. y Puig D. M. (1995). Clinical endocrinology, 42, 221-234.
[18] Lissoni P., et al. (1994). Oncology, 51(4), 344-347.
[19] Poeggeler, B., Reiter, R.J., Tan D. X., Chen L.D., -CO-C6H4-NO2. [20] Cardinali D.P., Pevet P. (1998). Med. Rev., 2, 175-190.
[21] Weissbach, H., Redfield B.G., and Axelrod J. (1960). Biochim. Biophys. Acta, 43, 352-353.
[22] Lewy A. J., R. Relkin Ed., (1989). The Pineal Gland, 77-128.
[23] Lewy A. J., Wehr, T. A., Goodwin F. K., Newsome D. A. y Markey S., Science, 210, 1267- 1269.
[24] Miller J. D., et al. (1996). Sleep, 19, 641-667.
[25] Miller J., Morin L.P., et al. (1994). Brain Res Rev, 67, 102-127.
[26] Kalsbeek et al. (2000). Eur J Neurosci, 12, 3146-3154.
[27] Klein, Berg & Weller J. (1960). Biochim. Biophys. Acta, 65, 352-353.
[28] Lovenberg W., Jequire E. y Sjoerdsma A. (1967). Science, 155, 217.
[29] Snyder S.N., Axelrod J., Wurtman R.T. y Fischer J.E. (1965). J. Pharmaco. Exptl Therap, 147, 371.
[30] Wurtman R.J y Antón T. F. (1969). Recent Progress in Hormone Researche, 25, 493. [31] Axelrod J. y Lauber J.K. (1962). Biochem Pharmacol, 17, 828.
[32] Yau K.W. (1994). Invest Ophthalmol Vis Sci, 35, 9-32.
[33] Kelly T. L., Smith D. y Naitoh P. (1989). Melatonin, Light and Circadian Cycles, San Diego: Naval Health Research Center.
[34] Malacara J. M. (1991). Fundamentos de Endocrinología. La glándula pineal, 4ª ed. México, Editorial Salvat, 113-121.
[35] Bubenik G. A. (2002). Digest Dis and Sci, 47, 2336-2348.
[36] Brzezinski A. (1997). The New England Journal of Medicine, 336(3), 186-195. [37] Harding R. M., Mills J. (1983). En: “Aviation Medicine Articles”, BMJ.
[38] Dahlitz M., Alvarez B., et al. (1991). Lancet, 337, 1121-1124.
[39] Pappolla M., et al. (1999). J. Biol. Chem, 273, 7185-7188.
[40] Atunes F., et al. (1999). Free Radical Biology & Medicine, 26, 117-128.
[41] Anastasiadis S. et al. International Journal of Neuroscience (1992). 62(3-4) 215-25. [42] Labhart A., Endocrinología Clínica Teórica y Práctica, 1a. Ed México, Salvat. 67-69. [43] Cavallo A. (1993). Journal of Pineal Research, 15(3), 115-121.
[44] Claustrat B., Brun J., David M. et al. (1992). Biol Psychiatry, 32, 705-711. [45] Cavallo A. (1993). J. Pediatr, 123, 843-851.
[46] Dollins A. et al. (1993). Psychopharmacology, 112, 490-496.
[47] Carman J. et al. (1976). Am J. Psychiatry, 133, 1181-1186.
[48] Garfinkel D, Laudon M, et al. (1995). Lancet, 346, 541-544.
[49] Deacon S. (1994). Neuroscience, 178, 32-34.
[50] Avendaño C. (2001). Introducción a la Química Farmacéutica, McGraw-Hill Interamericana 2a edición, 400-401.
[51] Vakkuri O., Leppaluoto J. y Vuolteenaho O. (1984). Acta Endocrinol.(Copenh),106, 152-157.
[52] Dubocovich M. L., Cardinali D. P., Delgrange P. et al. Melatonin Receptors. En "The IUPHAR Compendium of Receptor Characterization and Classification." IUPHAR Media, London, 271-275.
[53] Scher J., Wankiewicz E., Brown G. y Fujieda H. (2002). Investigative Ophthalmology and visual Science, 43, 3.
[54] Nosjean O., Ferro M., Coge F., Philippe Beauverger P., Jean-Michel Henlin, et al. (2000). The Journal of Biological Chemistry, 275(40), 31311–31317.
BIBLIOGRAFÍA
Cardinali D. P., Vacas M. I. y Boyer E.E., Endocrinology (1979). 105, 437-441. Marco M., Gilberto S., Franco F. et al. (1998). J. Med. Chem, 41, 3831-3844.
Miranda Morales, Marcela (2002). Efecto Ansiolítico de Análogos 1-N sustituidos de melatonina, en ratas con el modelo de plus-maze, Tesis, Facultad de Química, UNAM, México, D.F.
Prestch E., Clerc T., Seibl J., Simon W. (1980). Tablas para la elucidación estructural de compuestos orgánicos por métodos espectroscópicos, Alhambra, España, 189 y 200.
Pérez, Victor Hugo (2002). Síntesis Alterna y Evaluación de la Actividad Contráctil de la Agomelatonina Tesis, Facultad de Química, UNAM, México, D.F.