
eritromicilamina, intermediario en la síntesis de diritromicina
J. Rubén Gómez Castellanos1 y Gustavo A. Madrid Sánchez2.
1 Escuela de Ciencias Químicas, Universidad La Salle. E-mail: keyran_halcyon@yahoo.com
2 Huntsman Textile Effects, Basilea, Suiza.
E-mail: gustavo_alonso_madrid@huntsman.com
Recibido: Marzo 1, 2007. Aceptado: Julio 12, 2007
RESUMEN
La eritromicina es un antibiótico macrólido de amplio espectro, producido por una cepa de Streptomyces erythreus. Ha alcanzado gran importancia gracias a su actividad contra patógenos prevalentes como Legionella, Helliobacter, Micoplasma y Chlamydia.
En los últimos veinte años, se han dedicado esfuerzos sustanciales a las modificaciones estructurales de la eritromicina para mejorar sus propiedades biológicas. La diritromicina es el derivado 9-N-11-O-oxazina, obtenido de la condensación de la 9(S)- eritromicilamina con el 2-(2-metoxietoxi)acetaldehído. Es un antibiótico macrólido de nueva generación; su espectro de acción es similar al de la eritromicina, aunque la diritromicina presenta concentraciones más altas y prolongadas en los tejidos. La eritromicilamina es el intermediario sintético clave en la síntesis de la diritromicina y, comúnmente, se deriva de la eritromicina vía su oxima o su hidrazona lo que implica varios pasos de síntesis.
En este trabajo se planteó acortar el mecanismo de síntesis obteniendo la eritromicilamina directamente de la vía eritromicia, una reacción de aminación reductiva, formando la imina correspondiente con amoniaco y reduciéndola con cianoborohidruro de sodio, de acuerdo a un método propuesto por Borch y colaboradores. Se obtuvieron dos productos, de extracciones ácido-base. Al ser sometidos a espectrometría IR los productos revelaron la presencia del grupo carbonilo que se deseaba aminar, y la ausencia de las bandas del grupo amino. Esto indica que la aminación no se realizó y que la eritromicina fue degrada por mecanismo desconocido a productos aún no caracterizados.
Palabras clave: eritromicilamina, diritromicina, reducción aminativa, cianoborohidruro de sodio.
ABSTRACT
The erythromycin is a macrolide antibiotic of ample spectrum, produced by a stock of Streptomyces erythreus. It has reached great importance thanks to its activity against prevalent pathogens like Legionella, Helicobacter, Mycoplasma, and Chlamydia.
In the last twenty years, the erythromycin has been committed with substantial efforts to improve its structural and biological properties. Dirithromycin is the 9N-11-O-oxazine derivative, obtained out of condensation of 9(S)-erythromycyclamine with the 2-(2- methoxyethoxy) acetaldehyde. It is a macrolide antibiotic of new generation; its spectrum of action is similar to that of erythromycin, although dirithromycin presents higher and more prolonged concentrations in the weaves. Erythromycyclamine is the synthetic intermediary key in the synthesis of dirithromycin and, commonly, derived from the eritromicina via oxime or his hydrazones implying several passages of synthesis.
In this work, it was considered to shorten the synthesis mechanism obtaining erythromycyclamine directly via erythromycin, a reaction of reductive amination forming the corresponding amina with ammonia and reducing it with Sodium Cyanoborohydride, according to a method proposed by Borch and collaborators.
Two products of acid-base extractions were obtained. When subject to IR spectrometry, they revealed the presence of the group carbonyl wanted to be amined, and the absence of the bands of the amino group. This indicates that the amination was not made and that the erythromycin was degraded by an unknown mechanism to products not characterized yet.
Key words: Erythromycyclamine, Dirithromycin reductive amination, Sodium Cyanoborohydride.
PLANTEAMIENTO DEL PROBLEMA
Brockmann y Henckel [1] aislaron el primer antibiótico macrólido de una cepa de Streptomyces en 1950, al que llamaron picromicina, por su sabor amargo. Las características físicas de la picromicina y de otros antibióticos relacionados aislados subsecuentemente mostraban una característica en común, una lactona macrocíclica. De ahí que Woodward [2] propusiera el término macrólido para describir a esta clase de compuestos.
Los antibióticos macrólidos están clasificados, de acuerdo con el tamaño del anillo de la lactona macrocíclica, como anillos macrólidos de 12-, 14- o 16- miembros. Son de gran interés por su actividad antibiótica, en especial contra bacterias gram-positivas, cocos gram-negativos, y micoplasmas.
La eritromicina (fig. 1) es un importante agente antibiótico en quimioterapia, macrólido de 14 miembros, de amplio espectro, producido por una cepa de Streptomyces erythreus. Ha alcanzado gran importancia gracias a su actividad contra patógenos prevalentes como Legionella, Helliobacter, Micoplasma y Chlamydia [3,4,5]. En los últimos veinte años, se han dedicado esfuerzos sustanciales a las modificaciones estructurales de la eritromicina para mejorar sus propiedades biológicas.

La diritromicina (fig. 2) es un antibiótico macrólido de nueva generación derivado de la eritromicina A, inicialmente descubierto en Karl Thomae GmbH [6]. Aunque su espectro de acción es similar al de la eritromicina, la diritromicina presenta concentraciones más altas y prolongadas en los tejidos [7,8]. Es el derivado 9-N-11-O-oxazina, obtenido de la condensación de la 9(S)-eritromicilamina (fig. 3) con el 2-(2-metoxietoxi)acetaldehído. [9]

La aminación reductiva es el proceso mediante el cual los grupos carbonilos de aldehídos y cetonas son reducidos a la amina correspondiente en presencia de amoniaco, o una amina primaria.

Con base en lo anterior, creemos que el grupo carbonilo que se encuentra en la posición 9 del anillo macrólido de eritromicina, es susceptible a este procedimiento, para dar directamente la eritromicilamina (precursor de la diritromicina).
Borch y colaboradores [10], estudiaron la versatilidad y la notable selectividad del ion BH3CN- como agente reductor de aldehídos y cetonas a pH 6-7, y en el caso de nuestro interés, como agente reductor de la imina que se forma en presencia de amoniaco (aminación reductiva).
JUSTIFICACIÓN
El método común de síntesis de la eritromicilamina es preparando la oxima [11] o la hidrazona [12] de la eritromicina. Esto implica varios pasos de síntesis entre la eritromicina y la eritromicilamina, que deriva en altos costos.
Debido a la imperante necesidad que ha surgido de obtener derivados de la eritromicina para formular medicamentos de segunda y tercera generación, se propuso un método de aminación reductiva en la eritromicina A, utilizando el método propuesto
por Borch y colaboradores con cianoborohidruro de sodio (NaBH3CN) como agente reductor, lo que hace más corta la ruta sintética descrita arriba, con los beneficios en costos y tiempo que esto implica.
OBJETIVOS
1. Obtener la eritromicilamina en un paso, a partir de la eritromicina A por una reacción de aminación reductiva.
2. Constatar la eficacia del ion cianoborohidruro como agente reductor en esta reacción.
METODOLOGÍA
La reacción global que se plantea en este trabajo es la siguiente:

Se realizaron dos series de pruebas de la siguiente manera: dos soluciones de eritromicina A (7.34 g, 10 mmol), acetato de amonio, como fuente de amoníaco, (7.7 g, 100 mmol) y NaBH3CN (0.44 g, 7 mmol) en 30 ml de metanol puro fueron puestas en agitación por 48 horas a temperatura ambiente. Se añadió ácido clorhídrico concentrado hasta obtener un pH < 2. Se procedió a remover el metanol a presión reducida. El residuo se llevó a 10 ml de agua y se extrajo con tres porciones de 20 ml de éter. La solución acuosa se llevó a pH > 10 con hidróxido de sodio sólido y se extrajo con tres porciones de 15 ml de éter.
Los extractos etéreos se secaron con sulfato de sodio anhídrido, se decantaron y se eliminó el disolvente a presión reducida.
RESULTADOS
Durante la acidificación, las soluciones sufrieron un inesperado cambio de aspecto: la formación de una sustancia verde oscuro.
De manera similar, durante la basificación, las soluciones se tornaron a un color café amarillento.
Por tanto, se obtuvieron dos clases de productos: uno, el obtenido de la extracción en medio ácido, un sólido resinoso, verde brillante, con ligero olor a apio; otro, el obtenido de la extracción en medio básico, un sólido resinoso, café amarillento.
La eritromicina empleada, así como los productos, fueron sometidos a análisis por espectrofotometría de IR en un espectrofotómetro Perkin-Elmer RX I FT IR System y se compararon con estándares de eritromicina y eritromicilamina.
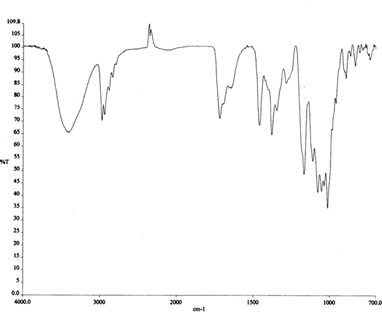
El espectro IR de la eritromicina (fig. 5) muestra las bandas características de los grupos funcionales que nos interesan. [13]. El espectro se caracteriza por tener bandas intensas en la región de 1000-1200 cm-1. Estas bandas se deben, probablemente, a la presencia de grupos de enlaces C─O─C. En la región de 1800-1600 cm-1 se observan
dos bandas. El primero, a 1716 cm-1, es comparable en intensidad y posición a la banda del grupo carbonilo. La segunda está a 1700 cm-1 y tiene una intensidad aproximadamente de la mitad de la banda de 1716 cm-1; probablemente, por su posición,
sea debida al carbonilo lactónico, aunque su intensidad no es característica. La banda a 3404 cm-1 indica la presencia de grupos hidroxilo en la molécula.
Los espectros de los productos obtenidos de la extracción ácida (fig. 6 y 7) muestran similitud con el de eritromicina en la región de 1720-1370 cm-1. Aquí, se observa la presencia de la banda del grupo carbonilo de la posición 9 a 1716 cm-1, mientras que la banda a 1700 cm-1 del grupo carbonilo lactónico, desapareció. Estos resultados indican, con la presencia de la banda de 1716 cm-1, que la aminación reductiva no tuvo lugar, y en la desaparición de la banda del carbonilo lactónico, que, posiblemente, el anillo macrólido se abrió.
Por otra parte, si la aminación reductiva tuvo lugar, se deberían de apreciar dos bandas de absorción, una cerca de 3500 cm-1, y otra cerca de 3400 cm-1. Estas bandas representan, respectivamente la tensión libre de los enlaces N─H simétrico y asimétrico. La banda de la vibración de flexión (tijereteo) del enlace N─H se debería percibir en la región de 1650-1580 cm-1. Los espectros no muestran las bandas esperadas si estuviera presente el grupo amino.
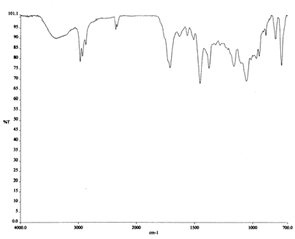
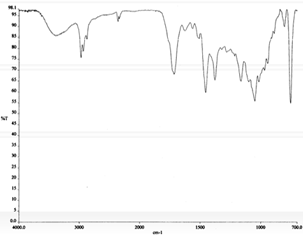
Figura 7. Espectro IR en CHCl3 del producto
ácido 2.
Los espectros de los productos obtenidos de la extracción básica (fig. 8 y 9) muestran también una similitud con el espectro de eritromicina en la región de 1720-1000 cm-1. Este rango es mucho mayor que el de los productos ácidos, lo que indica una mayor similitud entre estos productos y la eritromicina original.
La degradación de la eritromicina ha sido estudiada [13]. Se ha observado que bajo hidrólisis ácida se obtienen numerosos compuestos, entre ellos eritralosamina, cladinosa y desosamina.
En cambio se ha observado que la degradación en medio básico produce compuestos nuevos de carácter zwitteriónico, dependiendo de la concentración de base.
Las características físicas descritas para cualquiera de estos productos de degradación, ácido y básico, no concuerda con los productos obtenidos en nuestro experimento.
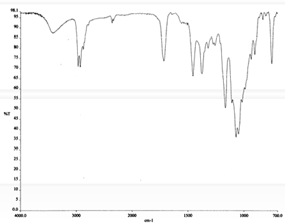
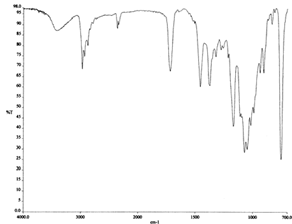
Figura 9. Espectro IR en CHCl3 del producto básico 2.
CONCLUSIONES
Al momento de realizar la primera serie del experimento, se creyó que el cambio de color de los extractos se debía a un manejo incorrecto de los reactivos, lo que accidentalmente derivó en productos de degradación indefinidos. Pero, cuando en la segunda serie, los mismos resultados se obtuvieron, y los espectros IR mostraron que los mismos productos se obtuvieron tanto en la extracción ácida como en la básica, resultó obvio que la reacción de aminación reductiva no estaba procediendo como fue previsto y que, en su lugar, otra reacción se estaba llevando a cabo, posiblemente como resultado, ya sea de las extracciones ácido-base, o por el poco calor suministrado durante la evaporación del metano, in vacuo.
Esto último fue propuesto, ya que en los primeros experimentos el cambio de coloración se daba hasta que se realizaba la evaporación, no inmediatamente después de acidificar. Aunque no fue el mismo caso con la fase básica, que sí cambió de color en cuanto se añadió la base.
Los espectros de IR arrojaron información interesante, aunque no concluyente. Como ya se dijo, podemos saber que la aminación reductiva no se llevó a cabo, ya que se observa la permanencia del grupo carbonilo y no la presencia de los enlaces N─H.
Los resultados reportados por Borch y colaboradores indican que, en la reacción de aminación reductiva, el primer paso consistente en la formación de la imina por la reacción del amoniaco y el grupo carbonilo. Reacción lenta a causa de las cetonas lineales. Es desconocido el efecto que una molécula del tamaño de la eritromicina, con todos los efectos estéricos que pueden tener sus grupos funcionales, en la formación de la imina. De manera similar, la iminación pudo haberse dado, pero no así la reducción por motivos desconocidos, y al momento de acidificar el medio, la imina se hidrolizaba a la cetona original.
Los productos obtenidos de las extracciones ácida y básica no fueron caracterizados, al no ser éste el objetivo de este trabajo. Pero en futuros trabajos, esta información podría arrojar luz acerca de la ruta que está siguiendo la reacción, lo que nos ayudaría a mejorar las condiciones de trabajo o los reactivos utilizados para intentar obtener la síntesis de la eritromicilamina por medio de la aminación reductiva de la eritromicina, o descartar definitivamente este procedimiento.
REFERENCIAS
[1] Brockmann, H., Henkel, W (1950). Naturwissenschaften, 37, 138.
[2] Woodward, R. B. (1957). Angew. Chem., Alemania, 69, 50.
[3] Brittain, D.C. (1987). “Erythromycin.” Med. Clin. N. Am., 71, 1147-1154.
[4] Nelson, J.D. (ed.) (1986). “Proceedings of a Symposium: The Evolving Role of Erythromycin in Medicine.” Pediatr. Infect. Dis. J., EUA, 5(1), 118-176.
[5] Washington, J. A., II, Wilson, W. R. (1985). Erythromycin: A Microbial and Clinical Perspective after 30 Years of Clinical Use.” Mayo Clin. Proc. EUA, 60, 189-203, 271-278.
[6] Luger, P., Maier, R. (1979). “Molecular Structure of 9-deoxy-11-deoxy-9,11-(imino(2- (methoxyethoxy)ethylidene) oxy)-(9S)-erythromycin. A New Erythromycin Derivative”. J. Cryst. Mol. Struct. EUA, 9, 329-338.
[7] Busch, U., et al. “Pharmacokinetic Properties of Dirithromycin (AS-E 136), A New Macrolide with High Tissue Penetration in Animals.” 8th Int. Symp. Future Trends Chemother., Italy, abstr. 29.
[8] Brogden, R. N., Peters, D.H. Drug. Eval. EUA, 48, 599-616.
[9] Counter, F. et al. (1991). “Synthesis and Antimicrobial Evaluation, of Dirithromycin (AS- E 136; LY237216), a New Macrolide Antibiotic Derived from Erythromycin.” Antimicrob Agents Chemother., EUA, 35(6), 1116-1126.
[10] Borch, R. F., Bernstein, M. D., Durst, H. D. “The Cyanohydridoborate Anion as a Selective Reducing Agent.” J. Am. Chem. Soc. EUA, 93(12), 2897-2904.
[11] Leeds, J. P., Kirst, H. A., Synth. Commun. EUA, 18, 777-782.
[12] Wildsmith, E. (1972). “The Reaction of Erythromycin Hydrazone with Nitrous Acid A New Route to Erythromycylamine” Tetrahedron Lett. 13(1), 29-30.
[13] Flynn, E. H., et al. (1954). “Erythromycin. I. Properties and Degradation Studies”, J. Am. Chem. Soc., 76(12), 3121-3131.
BIBLIOGRAFÍA
Ömura, S., Tanaka, H. Macrolide Antibiotics. Chemistry, biology and practice, EUA, Academic Press, 3-84.