María Isabel Castro-González1, Daniela Miranda-Becerra2 y Sara Montaño Benavides3,
1Investigadora en Ciencias Médicas “D”, SNI, Nivel 1, Responsable de Proyectos,
E-mail: isacastro55@yahoo.com.mx,castronutri11@prodigy.net.mx
2, 3Departamento de Nutrición Animal, Dirección de Nutrición,
Instituto Nacional de Ciencias Médicas Nutrición Salvador Zubirán,
Recibido: Octubre 11, 2008. Aceptado: Octubre 27, 2008
RESUMEN
Es indispensable un buen manejo nutricional en pacientes renales. La dieta debe incluir proteína de buena calidad con cantidades limitadas de fósforo (P) y potasio (K). Los ácidos grasos n-3 (AGPIn-3) de los pescados proporcionan beneficios contra la progresión del daño renal. El objetivo fue evaluar el contenido de proteína (PR), (P), (K), calcio (Ca) y AGPIn-3 en pescados procesados como una opción para pacientes renales. Se analizó atún en agua (AA), en aceite (AAC), sardina en tomate (ST), en chipotle (SC) y salmón ahumado (SA). (SA) presentó la mayor concentración de (PR), (P) y (K) y la menor cantidad de (AGPIn-3). Las sardinas presentaron el doble de la concentración de
(P) y (K) en comparación con los atunes, así como (Ca) en elevada concentración. Atunes y sardinas tuvieron altas concentraciones de AGPIn-3 (4256-5213 mg/100g); las relaciones P:AGPIn-3 y K: P:AGPIn-3 fueron muy bajas (0.03 a 0.06, para atunes y sardinas, respectivamente); (AA) y (AC) aportaron (10.1 y 11.1 mg(P)/g(PR); (ST) (26.4) y (SC)(19.1). AGPIn-3/g(PR) fue similar para atunes y sardinas (302-424). Se detectó diferencia significativa para (P) y (K) entre tipos de pescados. Se recomienda incluir de manera individualizada (AA) y (AC) en la dieta de pacientes renales, no así el consumo de sardina y salmón.
Palabras Clave: pescados procesados, fósforo, potasio, AGPI n-3, paciente renal.
ABSTRACT
Nutritional support in renal patients is necessary in their treatment. The diet must include limited amounts of high quality protein, phosphorus (P) and potassium (K). n-3PUFA maintains beneficial properties against the renal damage progression. The aim was to evaluate protein (PR), (P), (K), calcium (Ca) and n-3PUFA in processed fishes as an alimentary option to renal patients. Oil canned tuna (AA), water canned tuna (AC), tomato sauce sardine (ST), chipotle sardine (SC) and smoked salmon (SA) were analyzed. (SA) had the highest concentration of (PR), (P), and (K) and the lowest concentration of n- 3PUFA. Sardines had a double quantity of (P) and (K) compared with tunas, as well as (Ca) in a raise concentration. Tunas and sardines had elevated content of n-3PUFA (4256-5213 mg/100g); P:n-3PUFA and K: n-3PUFA were small in tunas and sardines (0.03 and 0.06). (AA) and (AC) contributed with 10.1 and 11.1 mg(P)/g(PR); (ST) (26.4) and (SC)(19.1). n-3PUFA/g(PR) content was similar for tunas and sardines (302-424). Statistical difference was detected to (P) and (K) between fishes’ groups. It is recommended to include, in an individualized way, (AA) and (AC) in renal patients’ diet, but avoiding sardine and salmon.
Key words: processed fishes, phosphorus, potassium, n-3PUFA, renal patient.
INTRODUCCIÓN
Las enfermedades renales se pueden clasificar en cinco categorías fisiológicas diferentes: insuficiencia renal aguda (IRA), insuficiencia renal crónica (IRC), enfermedad renal hipertensiva, síndrome nefrótico y anomalías tubulares. [1] En ellas se observa un deterioro de la función renal con acumulación de productos nitrogenados, como la urea y la creatinina y desequilibrio del agua y de algunos electrolitos (P, Na, K, Ca). La falla renal origina un desequilibrio metabólico proporcional a la pérdida de la función renal; la disminución o pérdida de los mecanismos reguladores del riñón pueden ser transitorios como en la IRA o permanentes como en el caso de la IRC. [2, 3]
La etiología de las enfermedades nefróticas es variada, siendo las más frecuentes la diabetes mellitus tipos 1 y 2 (31% en el tipo 1 y 42% en el tipo 2), la hipertensión arterial sistémica (17%), la infección de vías urinarias, la gota y las alteraciones en el metabolismo de los lípidos, además del empleo inadecuado de antimicrobianos y uso prolongado de antiinflamatorios no esteroideos (AINES). [4]
Las enfermedades nefróticas constituyen el cuarto problema de salud en América Latina. La IRC es una enfermedad que afecta a más de 100,000 mexicanos y a millones de personas en todo el mundo, en México representa el 56.3% de los ingresos hospitalarios. [5] La incidencia de las enfermedades renales registrada en Estados Unidos para niños (0-19 años de edad) es en promedio de 1/millón. Examinados por raza, los asiáticos del las islas de Pacífico y nativos americanos y blancos tienen menor incidencia (8,11 y 10 respectivamente en promedio/millón de la población infantil), que los niños de raza negra (17/millón de la p.i.); en América Latina, la incidencia de la IRC va desde 2.8 hasta 15.8/millón de habitantes menores de 15 años. [6]
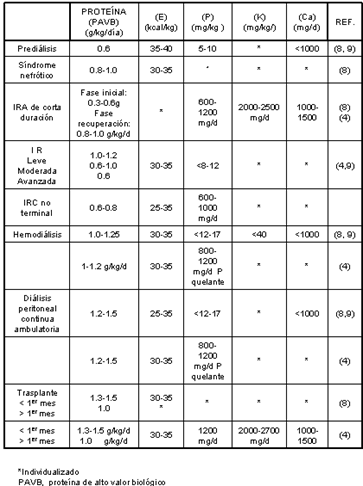
La terapéutica en las enfermedades renales consta de tratamiento médico y manejo nutricional. Este último es de suma importancia y puede hacer la diferencia en cuanto a la calidad y tiempo de vida del paciente. Debido a que las enfermedades nefróticas son diversas, el manejo nutricional tiene que ser diferente, de acuerdo a las condiciones físicas y niveles de los indicadores clínicos en cada paciente. Sin embargo, todo tratamiento nutricional incluye recomendaciones dietéticas con un consumo restringido de fósforo y potasio, además de proteína de alto valor biológico. [5,7,8,9] (Tabla 1). Este tipo de proteína se encuentra en los pescados, que además aportan importantes cantidades de los ácidos grasos poliinsaturados n-3 AEP (ac. Eicosapentaenoico C20:5) y ADH (ac. Docosahexaenoico C22:6). [10,11] Se ha demostrado que en pacientes renales, la proteinuria se previene prolongándose la sobrevivencia en modelos autoinmunes de nefritis, después de una dieta suplementada con aceite de pescado, además de que se han observado beneficios sobre el daño vascular, la agregación plaquetaria y los lípidos plasmáticos; en otros estudios se ha demostrado que los ácidos grasos n-3 parecen disminuir la nefrotoxicidad inducida por ciclosporina, así como una disminución de las complicaciones de la hipertensión al inhibir los mecanismos inflamatorios y aterogénicos en casos de nefritis lúpica, ayudando a conservar la función renal y reduciendo la proteinuria en nefropatías IgA. [12,13]
Los principales recursos pesqueros procesados en México son atún y sardina. El primero formado por atún aleta amarilla y atún aleta azul, y el segundo por sardina monterrey y sardina crinuda; este tipo de alimentos se consideran “de fácil consumo, barato y sabroso”. Se producen 16.5 millones de cajas de atún al año, equivalente a cerca de 800 millones de latas o 165 mil toneladas de este pescado. Según la Cámara Nacional de la Industria de Conservas Alimenticias (CANAINCA) el 84% representa el consumo de atún, 12.4% las sardinas y 0.6% otros recursos pesqueros. Las formas tradicionales de presentación son atún en aceite, atún en agua, sardina en salsa de tomate, sin embargo, la industria ofrece ahora una variedad más amplia como atún con verduras, con mayonesa, atún y sardina con chipotle, escabeche, etc. México es el quinto consumidor de atún enlatado en el mundo, con un consumo per cápita anual de 7 latas. [14]

Sin embargo, a pesar de la buena calidad de la proteína de estos pescados, dada por su contenido de aminoácidos, [15,16] se desconoce el riesgo-beneficio que éstos pudieran aportar al incluirse en la dieta de pacientes renales, por lo que el objetivo del presente trabajo fue evaluar el contenido de proteína, fósforo, potasio, calcio y AGPIn-3 en atún, sardina y salmón procesados, para su posible inclusión en el manejo nutricio de estos pacientes.
MATERIALES Y MÉTODOS
Muestreo
Atún y sardina: mediante un muestreo aleatorio simple se seleccionaron cinco latas de cada una de las marcas comerciales existentes en los diferentes supermercados de la ciudad de México. Para atún se muestrearon los medios agua y aceite; para sardina fueron tomate y chipotle.
Salmón: se eligieron al azar tres paquetes de un tipo de salmón que se oferta en la ciudad de México: salmón canadiense, ahumado, empacado al alto vacío.
Preparación de las muestras
Los contenidos, por separado, de cada una de las 5 latas de cada marca se molieron sin drenar hasta formar una pasta homogénea, la cual se sometió a los análisis químicos por triplicado (n=3).
Análisis químicos
Proteína cruda: se analizó de acuerdo a los métodos de prueba de la Norma Mexicana en un equipo automatizado Kjeltec 1032 Tecator. [17] Se presenta la media y desviación estándar de 2 repeticiones.
Minerales: el fósforo, el potasio y el calcio se analizaron de acuerdo a las técnicas descritas en el A.O.A.C. [18] El equipo utilizado para fósforo fue un espectrofotómetro marca Beckman, modelo Du70 (Método Interno, Espectrofotómetro MME-E1-02). El equipo para los otros minerales fue un espectrofotómetro de absorción atómica Perkin Elmer, Modelo Analyst 800 (Método Interno, Espectrofotómetro de absorción atómica MME-E1-01). Se presenta la media y desviación estándar de 3 repeticiones.
Ácidos grasos: Los ácidos grasos que se presentan en este trabajo corresponden a los poliinsaturados n-3 AEP (ac. Eicosapentaenoico, C20:5 n-3) y ADH (ac. Docosahexaenoico), C22:6 n-3). Se analizaron según la técnica descrita por Castro y cols. para muestras de pescado. Cada muestra se pesó por triplicado (1±0.01g). Para la identificación y cuantificación de los ésteres metílicos de los ácidos grasos obtenidos, se utilizó una mezcla de estándares Supelco 37 Fame Mix (USA), comparando con los tiempos de retención y áreas correspondientes entre éstos y la muestra. Se utilizó un cromatógrafo de gases Varian 3400CX, con una columna capilar de 100m x 0.25mm Supelco SP2560 (USA). La detección de los ácidos grasos fue por ionización de flama. El volumen de inyección fue de 1 uL (split 1:100) por duplicado en cada muestra y se utilizó como estándar interno el éster metílico del ácido miristoleico. Los resultados de los ácidos grasos se presentan en mg/100 g de la porción comestible.
Análisis estadísticos
Se realizó un análisis descriptivo para cada grupo de resultados. Los resultados se agruparon de acuerdo al tipo de pescado y medio en el que se consume y se aplicó un análisis de varianza de una vía (ANOVA) seguido de una prueba de Tukey HSD para n desigual con un nivel de significancia de P<0.05. Se utilizó el paquete estadístico Statistical Software para Windows Versión 7. [19] Los datos se expresan en media ± DS en el texto y las tablas.
Resultados
En la Tabla 2 se presentan los resultados del contenido de proteína (PC), fósforo, potasio y calcio en pescados procesados (atún, sardina y salmón). Los productos enlatados de atún y sardina proceden de diferentes localidades de la región del Pacífico mexicano y el salmón ahumado fue producido en Canadá. El atún enlatado se encontró en 2 medios: en agua y aceite. El atún en aceite presentó los valores mas bajos en fósforo (140.75 mg/100g) y potasio (142 mg/100g). El atún en agua presentó los valores mas bajos de calcio (19.5 mg/100g). La proteína encontrada en el atún enlatado en agua y aceite, presentaron valores de (14.05 y 14.36 g/100g), respectivamente. La sardina enlatada también se encontró en 2 medios: en salsa de tomate y salsa chipotle, presentando los valores más altos en calcio tanto en tomate como en chipotle (108 mg/100g).
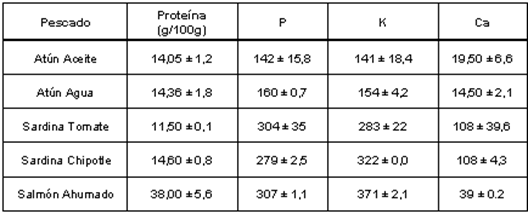
La proteína encontrada en los pescados procesados (Tabla 2) varió desde 11.5 g/100g (sardina en salsa chipotle) hasta 38 g/100g (salmón ahumado). La proteína en atún procesado puede variar desde 15.6 hasta 21.7 g/100g porción comestible, según datos encontrados en las Tablas del Valor Nutritivo, [15, 16] en las cuales tanto atún en agua como en aceite reportan los valores mínimos, mientras que el enlatado en aceite también presentó los más altos. La sardina en tomate presentó una concentración 30% menor a lo reportado en las Tablas (15.4–15.9), mientras que para sardina en chipotle no se encontraron valores reportados. Esta variación que se presenta en la composición química en los productos procesados se debe a factores bióticos y abióticos existentes en los recursos pesqueros tales como la especie, el estado fisiológico, zona de profundidad y época de captura, tipo de músculo (graso, semigraso y magro), estación de año y a los procesos a los cuales son sometidos antes de su comercialización y consumo. [10,11,20] El salmón ahumado presentó los valores más altos de proteína, debido probablemente a que el proceso de ahumado deshidrata el músculo y eleva la concentración de nutrimentos.
De los pescados analizados, las sardinas presentaron el mayor contenido de (P), principalmente la sardina en tomate con 303 mg/100g. Este valor también fue mayor a lo reportado en un estudio para minerales en sardina en salsa de tomate de diferentes localidades del Pacífico mexicano (201-284 mg/100g). [21] Los valores de (P) encontrados en el presente trabajo están muy por debajo a lo informado por otros autores para atún en aceite (294-595 mg/100g). [15,22,23]. Esta variación indica la influencia que tienen los factores bióticos y abióticos sobre este mineral, así como el cuidado que se debe tener, al incluir atún en la dieta de pacientes renales, cuyo consumo de (P) esté verdaderamente limitado (Tabla 1).
El mayor contenido de (K) se encontró en el salmón ahumado, sardina en chipotle y sardina en tomate, con 371, 322 y 283 mg/ 100g (Tabla 2). Es muy probable que estos valores se hayan visto elevados por la presencia de otros alimentos ricos en minerales, tales como la salsa de tomate y el chipotle [15,16] y el proceso de ahumado que deshidrata la carne. El contenido de (K) del atún fue similar a lo informado por otros autores (137.5-149 mg/100g) [22]; para la sardina en tomate, Castro, et al. [21] presenta un intervalo muy amplio en este mineral (57-597 mg/100g) dependiendo de la localidad de captura del recurso, los valores encontrados en el presente trabajo se encuentran dentro del intervalo antes mencionado. Como se puede observar, el (K) es un mineral menos influenciado por el medio y los procesos de enlatado.
El salmón ahumado presentó los valores más elevados de (K) y (P), en comparación con los pescados enlatados.
El (Ca) (Tabla 1), como era de esperarse fue muy elevado para la sardina en ambos medios, ya que este tipo de pescados se procesa con espinas, ricas en este micronutrimento. Los valores encontrados fueron menores a los informados en Tablas (227 mg/100g) [16] y similares a los informados por Castro, et al. [21] para sardina en tomate de diferentes localidades (61-118 mg/100g).
En la tabla 3 se presenta el contenido de ácidos grasos poliinsaturados n-3 (AEP y ADH) en pescados procesados. El salmón ahumado presentó los valores más bajos tanto en AEP (41 mg/100g) como en ADH (65.29 mg/100g), en relación a los productos enlatados; donde el atún en aceite y el atún en agua presentaron los valores más altos de AEP (1122 y 1024 mg/100g, respectivamente), sin embargo, la sardina es más rica en ADH. La sardina en chipotle presentó el valor más alto de ADH (4177 mg/100g), alcanzando así la mayor concentración de AGPI n-3 en los pescados procesados estudiados, sin embargo, no se encontró diferencia significativa P>0.05 entre atunes y sardinas para el total de AGPI n-3, no ocurriendo así entre estos grupos y el salmón (P<0.05).
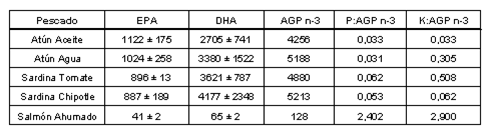
La relación entre el contenido de (P), (K) y la concentración de ácidos grasos poliinsaturados n-3 AEP se presenta en la Tabla 3, donde se observó una relación 100% mayor para las sardinas en comparación con los atunes. El salmón ahumado presentó una proporción muy elevada de (P) y (K) en comparación con los AGPI n-3. En general, los pescados enlatados estudiados tienen una relación muy aceptable, entre los minerales limitantes para pacientes renales y los ácidos grasos n-3, benéficos para su salud debido a la elevada concentración de estos últimos.
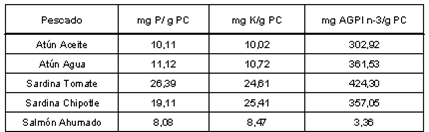
En la Tabla 4 se presenta el aporte de (P), (K) y AGPI n-3/g de proteína. Las sardinas presentaron un aporte de ambos minerales de más del doble por gramo de proteína, en comparación con los atunes, quienes presentaron valores similares entre ellos. Sin embargo, el aporte de ácidos grasos n-3/g de proteína fue mayor en la sardina en tomate y menor en la enlatada con chipotle. Por su elevado contenido de proteína cruda, el salmón presentó un aporte menor de minerales/g de proteína, pero muy baja contribución de AGPI n-3/g de proteína.
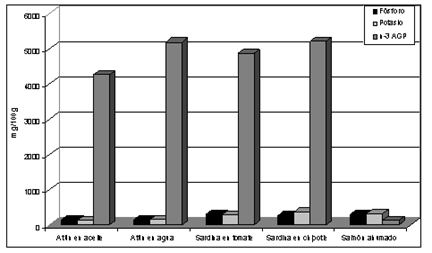
En la Figura 1 se presenta gráficamente el contenido de P, K y AGPI n-3 en pescados procesados. Los pescados enlatados con la menor cantidad de estos minerales y una elevada concentración de ácidos grasos poliinsaturados n-3 fueron el atún en agua y aceite.
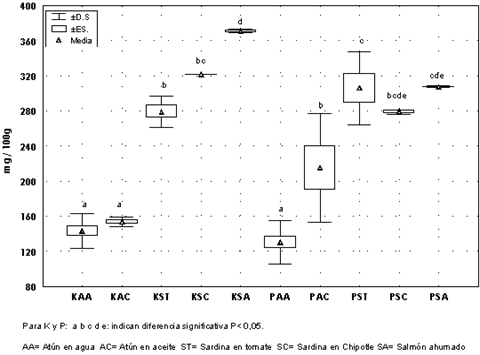
En la Figura 2 se presentan gráficamente los resultados del análisis estadístico entre los diferentes tipos de pescados, para cada uno de los minerales analizados. Se detectó diferencia significativa P<0.05 para el (K) entre las diferentes especies de pescados pero no entre los medios que se aplicaron en cada grupo de pescados. El (P) presentó un comportamiento diferente, ya que se puede observar diferencia significativa P<0.05, entre atún en agua y atún en aceite, así como entre éstos y sardina en tomate. Sólo se detectó diferencia estadística entre sardina en chipotle y atún en agua, así como entre el salmón ahumado y los atunes. Esta diferencia es posible que se deba al tipo y cantidad de fosfatos que se incluyen en los procesos de enlatado en las diferentes especies, ya que éstos pudieran estar influyendo en la concentración de (P) encontrada.
Discusión
Por un lado, la mortalidad de origen cardiovascular es la más frecuente en pacientes en tratamiento dialítico crónico, por el otro, los pacientes con insuficiencia renal crónica padecen de un deterioro importante de sus arterias, tanto de tipo estructural como fisiológico; siendo generalmente la localización del daño en arterias de mediano calibre. Las calcificaciones arteriales son comúnmente observadas en pacientes urémicos y constituyen un aceleramiento en el proceso de envejecimiento. Además, cada vez hay más evidencia de que la calcificación arterial está asociada a incrementos de la rigidez arterial y al riesgo de muerte cardiovascular. Es importante destacar que la patología renal y cardiovascular se desarrolla, en general, al mismo tiempo, especialmente en la hipertensión y la diabetes, lo que implica que cuando el paciente progresa en su enfermedad renal, antes de estar urémico, ya tiene lesiones vasculares importantes y calcificaciones relacionadas con su enfermedad base. A esta patología existente se le agregan las calcificaciones dependientes del estado urémico y de las alteraciones del metabolismo fósforo-calcio. [24]
Considerando las recomendaciones de fósforo, potasio y proteína para pacientes renales (Tabla 1), por ejemplo, en el caso de pacientes con IRA o IRC en los cuales se permite un consumo mínimo de 600-800 mg/d de (P), considerando el uso de quelantes y 2000-2700 mg/d de (K), también tomando en cuenta el consumo de quelantes de potasio, un consumo de 100g de atún en aceite proporcionarían 140 mg de (P) y 4,256 mg de AGPI n-3, mientras que el salmón contribuirá con 307 mg (P) y 127.7 mg de AGPI n-3; la sardina aportaría 303.5 mg (P) y 4,879.5 mg AGPI n-3, lo cual es un dato a considerarse si se toma en cuenta que no es el único alimento que se consume en una dieta balanceada.
En el caso del potasio el atún en aceite proporcionaría 141 mg de (K) y 4,256 mg de AGPI n-3. Será necesario hacer el cálculo para cada uno de los pescados procesados en relación a las recomendaciones de (P), (K) y proteína en la dieta de cada paciente.
En el tema de las calcificaciones arteriales, se sabe que son mucho más comunes y más severas en pacientes en plan de hemodiálisis que en ausencia de insuficiencia renal. Es por este motivo que la prevención de las calcificaciones arteriales se realiza tratando la hiperfosfatemia y la hipercalcemia. [24, 25] Desde este punto de vista, por su contenido de calcio, las especies estudiadas no presentan riesgo para su consumo por parte de los pacientes nefróticos, ya que el pescado con mayor contenido de calcio en músculo (sardina en agua y aceite, 108 mg/100g). Por otro lado, el hiperparatiroidismo secundario se inicia tempranamente en el curso de la insuficiencia renal crónica. Los factores implicados en la patogénesis del hiperparatiroidismo secundario incluyen las alteraciones del metabolismo del fósforo y calcio, la deficiencia de calcitriol, anormalidades de la glándula paratiroidea y resistencia esquelética a la acción calcémica de la hormona paratiroidea. Es importante señalar que estos factores patogénicos están fuertemente interrelacionados y, como consecuencia, las alteraciones en unos afectan a los otros. [24] Algunos estudios han demostrado que el consumo temprano y prolongado de aceite de pescado disminuye la progresión de la enfermedad renal en pacientes con neuropatía IgA. [26] Otro estudio llevado a cabo en un tiempo corto, de entre 3 y 6 meses, concluyó que pacientes con nefropatía IgA idiopática con proteinuria y filtrado glomerular medianamente reducido, no se beneficiaron al consumir 4 g/d de n-3 PUFA, pero las ventajas se obtuvieron al mejorar la disfunción tubular, en los perfiles lípidos y en el estrés oxidativo. [27] El aporte de n-3 PUFA en pacientes con enfermedad glomerular se asoció a un incremento en la tasa de filtración glomerular y del flujo plasmático y una reducción de proteinuria. [28] La CRF produce alteraciones lipídicas que contribuyen a la progresión del daño renal y a una ateromatosis acelerada, pero el consumo de n-3 PUFA podría tener un efecto favorable en el perfil lipoprotéico de la CRF. [29] Finalmente, pero no menos importante, la enfermedad cardiovascular es la principal causa de morbi- mortalidad en pacientes con CRF. Se ha demostrado que los n-3 PUFA pueden mejorar la evolución de las enfermedades cardiovasculares, por lo que estos efectos benéficos se pudieran extrapolar a pacientes urémicos. [30]
CONCLUSIONES
El atún en agua y en aceite se podrían incluir en la dieta de pacientes renales si se toma en cuenta, de manera individual, el riesgo-beneficio que se puede obtener por la elevada concentración de los ácidos grasos n-3, por un lado, y la presencia de (K) y (P), por otro, presentes en estos pescados. Se debe recordar que los beneficios de este tipo de ácidos grasos se obtienen si el consumo de pescado se efectúa de forma regular, al menos tres veces por semana. La sardina, tanto en tomate como en chipotle, no se recomienda por su elevado contenido de minerales limitantes, en la dieta del paciente renal. Por su valor económico y por los valores nutrimentales, encontrados en el presente trabajo, se recomienda no ofrecer salmón ahumado a los pacientes renales.
AGRADECIMIENTOS
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología por el apoyo otorgado para la elaboración del proyecto al cual pertenece el presente trabajo. Apoyo CONACYT Clave 52811-Q. Al Q.F.B. Héctor Ledesma Centeno por su apoyo en el análisis de proteína del salmón.
BIBLIOGRAFÍA
[1] Espinosa-Cuevas, M. A. y Miranda, A. P. (2003). Evaluación del estado de nutrición en el paciente nefrópata. Nutrición Clínica, Madrid: Sociedad Española de Dietética y Ciencias de la Alimentación (S.E.D.C.A.), vol. 6, no. 3, pp. 237-251.
[2] Bustamante, A. A. y Navarro, A. (2008). Nefroesclerosis arteriolar y fracaso renal agudo por fármacos. En: Terapéutica en enfermedades renales. Manual de Residentes. Madrid: Sociedad Española de Farmacia Hospitalaria. pp. 447-463. [En línea]. Disponible en: <http://www.sefh.es/manual/VU2_98_Capitulo_3_06.pdf>, consulta: abril 4 de 2008.
[3] Castaño, I., Rovetto, C. (2007). Nutrición y enfermedad renal. Colombia Med, Colombia: Corporación Editora Médica del Valle ene-mar., vol. 38, supl. 1, pp. 56-65. [En línea]. Disponible en: <http://colombiamedica.univalle.edu.co/>, consulta: abril 8 de 2008.
[4] Cisneros, G. A. (2003). Factores de riesgo para la progresión del daño renal. Nutrición Clínica, Madrid: Sociedad Española de Dietética y Ciencias de la Alimentación (S.E.D.C.A.), vol. 6, no. 3, pp. 317-319.
[5] Vélez-Salazar, I., González-Michaca, L. y Correa-Rotter, R. (2001). Alteraciones renales y nutrición. En: Casanueva, E., et. al. Nutriología Médica, 2a. edic., México: Médica Panamericana, pp. 390-409.
[6] Fundación Mexicana del Riñón. (2005). [En línea] Disponible en:
<http://www.fundrenal.org.mx>, consulta: abril 8 de 2008.
[7] Gastelbondo, A. R. y Mesa, M. P. (2008). Mesa MP. Etiología y estado actual de la insuficiencia renal crónica (IRC) en Pediatría. Pediatría. Colombia, vol. 35, no. 4, 20p. [En línea] Disponible en: <http://encolombia.com/rcp.htm>, consulta: marzo 27 de 2008.
[8] Espinosa-Cuevas, M. A. (2003). ¿Por qué es tan importante la intervención dietética durante la enfermedad renal?, Nutrición Clínica, Madrid: Sociedad Española de Dietética y Ciencias de la Alimentación (S.E.D.C.A.), vol. 6, no. 3, pp. 207-208.
[9] Pender, F. (1999). Renal function and disorders. Encyclopedia of Human Nutrition, Sadler, M. J. editor, UK: Academic Press, vol. 3, pp. 1701-1707.
[10] Castro-González, M. I., Ojeda, V. A., Silencio, B. J., Cassis, N. L. y Ledesma, C. H. (2004). Perfil lipídico de 25 pescados marinos mexicanos con especial énfasis en sus ácidos grasos n-3 como componentes nutracéuticos. Archivos Latinoamericanos de Nutrición, Venezuela: SCIELO, vol. 54, no. 3, pp. 328-336. [En línea] Disponible en:
<http://www.scielo.org.ve/scielo.php?script=sci_issuetoc&pid=0004- 062220040003&lng=es&nrm=iso>, consulta: marzo de 2008.
[11] Castro-González, M. I., Ojeda, V. A., Montaño, B. S. y Ledesma, C. H. (2007). Ácidos grasos n-3 de 18 especies de pescados marinos mexicanos como base para su empleo como alimentos funcionales. Archivos Latinoamericanos de Nutrición, Venezuela: SCIELO, vol. 57, no. 1, pp. 85-93. [En línea] Disponible en:
<http://www.scielo.org.ve/scielo.php?script=sci_issues&pid=0004- 0622&lng=es&nrm=iso>, consulta: marzo de 2008.
[12] De Caterina, R., et al. (1994). n-3 fatty acids and renal diseases. American Journal of Kidney Disease, UK: Elsevier, vol. 24, no. 3, pp. 397-415.
[13] Donadio, J. V. y Grande, J. P. (2004). The role of fish oil/omega-3 fatty acids in the treatment of IgA nephropathy. Seminars in Nephrology, UK: Elsevier, vol. 24, no. 3, pp. 225-243.
[14] Anónimo. (2006). La Industria atunera está de vuelta. Mundo Ejecutivo., no. 319. [En línea] Disponible en:
<http://ejecutivo.mundoejecutivo.com.mx/articulos.php?id_sec=10&id_art=189>, consultada: agosto 25 de 2008.
[15] Muñoz, C. M., Ledesma, S. J. A., Chávez, V. A., Pérez-Gil, R. F., Castro-González,
M. I. y Ávila, C. A. (2002). Los Alimentos y sus Nutrientes. Tablas de Valor Nutritivo de Alimentos, 2a. edic., México: McGraw-Hill Interamericana, 203pp.
[16] Morales, L. J., et al. (2000). Tablas de Composición de alimentos mexicanos, México: INCMNSZ, 237pp.
[17] NMX-608-NORMEX-2002. (2002). Alimentos. Determinación de proteínas en alimentos. Método de Prueba, México.
[18] A.O.A.C. (2003). Métodos N 968.08(b), 965.17, tabla 965.09, N 968.090(b),
935.13A(a), 987.03, 987.02, 965.09(D),17a. edic., USA: Official Methods of Analysis of the Association of Official Analytical Chemists.
[19] StatSoft, Inc. Statistica for Windows. Tulsa, USA: StatSoft Inc.
[20] Drazen, J. C. (2007). “Depth related trends in proximate composition of demersal fishes in the eastern North Pacific”. Deep Sea Research Part I: Oceanographic Research Papers. February, UK: Elsevier, vol. 54, no. 2, pp. 203-219.
[21] Castro-González, M. I., Pérez-Gil, R. F., Montaño, B. S. y Silencio, B. J. L. (1999). Vitaminas y minerales de sardina en salsa de tomate, colectada en las zonas pesqueras del Pacífico mexicano. Archivos Latinoamericanos de Nutrición, Venezuela: SCIELO, vol. 49, no. 4, pp. 379-383.
[22] Castro-González, M. I. y Pérez-Gil, R. F. (1998). Vitaminas y minerales del atún aleta amarilla (Thunnus albacares) del Pacífico mexicano enlatado en aceite. Archivos Latinoamericanos de Nutrición, Venezuela: SCIELO, vol. 48, no. 3, pp. 265-268.
[23] Lall, S. P. (1995). Macro and trace elements in fish and shellfish. En: A. Ruiter, ed.
Fish and Fishery Products. UK: CAB Internacional, pp.187-214.
[24] Argote, G. y González, E. (2004). Hiperparatiroidismo secundario. Nefr. Lat., vol. 11, pp. 13-22.
[25] Galli, C. N., Risk, M. R., Camus, J. M. y Cabrera, F. E. (2004). Calcificación arterial y su evaluación funcional en la enfermedad renal crónica. Revista de Nefrología, Diálisis y Transplantes, Buenos Aires: Asociación Regional de Diálisis y Trasplantes Renales, vol. 24, pp. 165-170.
[26] Donadio, J. V., Grande, J., Bergstralh, E., et al. (1999). The Long-Term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Journal of the American Society of Nephrology, USA: American Society of Nephrology, vol. 10, pp. 1772-1777.
[27] Parinyasiri, U., Ong-Ajyooth, L., Parichatikanond, P., Ong-Ajyooth, S., Liammongkolkul, S. y Kanyog, S. (2004). Effect of fish oil in oxidative stress, lipid profile and renal fuction in IgA nephropathy. Journal of the Medical Association of Thailand. September, Thailand: World Medical, vol. 87, no. 2, pp. 143-149.
[28] De Caterina, R., Caprioli, R., Giannessi, D., et al. n-3 fatty acids reduce proteinuria in patients with chronic glomerular disease. Kidney International, UK: Nature Publishing Group, vol. 44, pp. 843-850.
[29] Svensson, E., Schmidt, K., Jørgensen, K., y Christensen, J. (2004). The effect of n-3 fatty acids on lipids and lipoproteins in patients treated with chronic haemodialysis: a randomized placebo-controlled intervention study. American Journal of Kidney Disease, UK: Elsevier, vol. 44, pp. 77–83.
[30] Levin, A. y Foley, R. N. (2000). Cardiovascular disease in chronic renal insufficiency.
American Journal of Kidney Disease, UK: Elsevier, vol. 36, pp. S24-30.
REFERENCIAS
Donadio, J. V., Larson, T. S., Bergstralh, E. J. y Grande, J. P. (2001). A randomized trial of high-dose compared with low-dose omega-3 fatty acids in severe IgA nephropathy. Journal of the American Society of Nephrology, USA: American Society of Nephrology, vol. 12, pp. 791-799.
Huss, H. H. (1999). El pescado fresco: su calidad y cambios de su calidad. FAO. Documentos técnicos de Pesca, T348. [En línea] Disponible en:
<http://www.fao.org/docrep>, consultada: junio de 2008.
Iverson, S. J., Field, Ch., Don Bowen, W. y Blanchard, W. (2004). Quantitative fatty acid signature analysis: a new method of estimating predator diets. Ecological Monographs, Washington, D.C.: ESA, vol. 74, no. 2, pp. 211-235.
Iverson, S. J., Frost, K. J. y Lang, S. L. C. (2002). Fat content and fatty acid composition of forage fish and invertebrates in Prince William Sound, Alaska: factors contributing to among and within species variability. Marine Ecology Progress Series, Germany: Inter-Research Science Center, vol. 241, pp. 161-181. [En línea] Disponible en: <http://www.int-res.com/articles/meps2002/241/m241p161.pdf>, consultada: enero de 2008.
Rice, R. (1999). Fish. Nutritional Value. Encyclopedia of Human Nutrition, Sadler, M.J. ed., UK: Academic Press, vol. 3, pp.793-803.
Romero, P. N., Robert, C. P., Masson, S. L. y Pineda, L. R. (2000). Composición de ácidos grasos y proximal de siete especies de pescado de Isla de Pascua. Archivos Latinoamericanos de Nutrición, Venezuela: SCIELO, vol. 50, pp. 304-308.
Schiro-Harvey, K. (2002). National Renal Diet: Professional Guide. 2nd. edit., USA: ADA 48pp.
United States Department of Agriculture. Agricultural Research Service. Version current 16 May 2008. [En línea]. Disponible en:
<http://www.ars.usda.gov/nutrientdata>, consultada: junio de 2008.