
1Alejandra Lamadrid Avendaño,
2Lilia Angélica Bernal Gracida y 3María Guadalupe Morales Meza Escuela de Ciencias Químicas, Universidad La Salle
E-mail: 1alejandralamadrid@hotmail.com, 2labg@ulsa.mx,3mgmm@ulsa.mx
Recibido: Marzo 2, 2008. Aceptado: Noviembre 8, 2008
RESUMEN
Se evaluó la capacidad prebiótica de los gránulos de almidón de papa en bacterias ácido láctica (BAL) con características probióticas. Se utilizaron muestras de almidón de papa de diferentes variedades y almidón de maíz que se utilizó para comparar los resultados con un almidón de diferente origen. Se caracterizó el almidón midiendo: el tamaño del gránulo, el contenido de amilosa y de amilopectina, el nivel de fosforilación, la susceptibilidad a la hidrólisis enzimática y ácida y el contenido de almidón resistente (AR) para conocer si estos factores determinan la capacidad prebiótica del almidón. Se encontró que el tamaño de gránulo y el contenido de amilosa determinaron la resistencia a la hidrólisis enzimática que presentaron los almidones de papa. En la hidrólisis ácida los almidones con mayor contenido de amilosa presentaron una mayor resistencia a la degradación. El almidón de papa presentó en promedio un 80% de AR y el de maíz un 44.6%. El almidón de papa por su alto contenido de almidón resistente puede ser un prebiótico potencial para las BAL del colon. En los ensayos de la capacidad amilolítica, cosedimentación y fermentación se trabajó con 44 BAL silvestres y con Lactobacillus casei Shirota y Acti regularis como cepas probióticas control. Las BAL no presentaron actividad amilolítica, sin embargo, presentaron un alto porcentaje de bacterias adheridas a los gránulos de almidón de las diferentes variedades de papa que va de un 75% hasta un 99%, siendo esta asociación un mecanismo de protección para las bacterias ante las condiciones del tracto gastrointestinal. No obstante que el almidón no fue hidrolizado por las BAL se realizó el estudio tendiente a la identificación de los productos de fermentación con la glucosa, que es uno de los productos de la hidrólisis del almidón. Las BAL produjeron ácido láctico como metabolito principal y algunas de éstas dieron pequeñas cantidades de ácido butírico metabolito deseado en una cepa probiótica.
Palabras Clave: prebiótico, probiótico y almidón resistente.
ABSTRACT
Potato starch granules prebiotic capacity was evaluated in lactic acid bacteria (LAB) with probiotic characteristics. Samples from a variety of potato and maize starch were used to compare results against a starch of different origin. The starch was characterized by measuring the granule size, the amylase and amilopectin content, the phosphorylation level, the susceptibility to enzymatic and acidic hydrolysis, and the content of resistant cotton (RC) to know if these factors determine the starch prebiotic capacity. It was found that the granule size and the amylase content determined the enzymatic hydrolysis resistance showed by the potato starches. In the acidic hydrolysis starches with greater amilose content showed a higher resistance to degradation. The potato starch showed an average of 80% of RC and the one of maize 44.6%. Due to its high content of resistant starch, the potato starch may be a potential prebiotic for the colon’s LAB. During the essays of amylolithical capacity, co-sedimentation, and fermentation 44 wild LAB and Lactobacillus casei Shirota and Acti regularis were used as probiotic control stocks. LAB did not present amylotithical activity; nevertheless, they presented a high percentage of adhered bacteria to the starch granules of the several potato varieties that goes from 75% to 99%, being this association a mechanism of protection for bacteria for the gastrointestinal tract conditions. Although the starch was not hydrolyzed by LAB a study tending to identify glucose fermented products was performed, which is one of the products of the starch hydrolysis. LAB produced lactic acid as the main metabolite and some of these produced small amounts of desired metabolite butyric acid in a probiotic stock.
Keywords: preboitic, probiotic, resistant starch. INTRODUCCIÓN
Debido a la demanda de los consumidores por alimentos que promuevan la salud, la industria de los alimentos ha desarrollado alimentos funcionales. El concepto de alimento funcional incluye alimentos o ingredientes alimentarios que ejercen algún beneficio adicional específico en la salud del consumidor, más allá de su valor nutricional básico. [1] Dentro de éstos se encuentran los probióticos, prebióticos y simbióticos, los cuales mejoran el balance de la microbiota del intestino humano, mejorando la salud del consumidor. [2]
Los probióticos son microorganismos vivos que se usan como suplemento en algunos alimentos y proveen efectos positivos en la salud del consumidor, ya que mejoran la composición de la microbiota del intestino. [3] Los probióticos más importantes asociados con el tracto intestinal humano son las bacterias ácido lácticas (BAL). [4] Estas bacterias se han asociado con la disminución de la intolerancia a la lactosa, el aumento en la resistencia de infecciones gastrointestinales, la mejora de la digestión, la reducción de los niveles de colesterol y la disminución del riesgo de cáncer de colón. [5]
Por otro lado los prebióticos se definen como ingredientes alimentarios que no son digeridos por el hombre y estimulan el crecimiento de un limitado género de bacterias que habitan el colon, como las BAL, de tal forma que mejoran el balance de la microbiota del colon. [6,7] El almidón en la dieta del hombre es la mayor fuente de carbohidratos y en las plantas es el principal componente de almacenamiento, específicamente se sintetiza en los cloroplastos de las hojas verdes y en los amiloplastos de las semillas y tubérculos formando gránulos. [8] Algunos almidones tienen digestión incompleta y no son absorbidos en el intestino delgado, debido al tamaño del gránulo y a su estructura molecular; a este tipo de almidón se le ha nombrado como almidón resistente. [3] El almidón resistente llega al colon donde es fermentado por la microbiota generando ácidos grasos de cadena corta (AGCC), como el acético, el propiónico y el butírico. [9] Siendo este último el de mayor importancia en la salud ya que es fuente de energía para las células del epitelio y este compuesto también protege a las células de daños al ADN, de esta manera puede prevenir el cáncer de colon. [10]
Se han estudiado alternativas para mejorar la viabilidad de los probióticos, siendo uno de los avances en la industria de los alimentos la combinación de probióticos con prebióticos, dando lugar a lo que se conoce como: simbiótico. Se ha demostrado que algunas bacterias intestinales pueden adherirse al almidón in vitro y esta adhesión algunas veces va acompañada de una eficiente utilización del sustrato. La adhesión de las bacterias al almidón proporciona protección hacia los factores adversos que se presentan tras el paso por el tracto gastrointestinal promoviendo una mayor distribución de probióticos viables en el colon. [3,7] En este trabajo se evaluó la utilización como sustrato y la capacidad de adhesión de una colección de 44 bacterias ácido lácticas silvestres con características probióticas a los gránulos de almidón de papa para conocer su posible asociación benéfica. Se analizó la susceptibilidad a la hidrólisis ácida y enzimática de los gránulos de almidón; además, se determinaron algunas de sus características fisicoquímicas para conocer si éstas determinan su capacidad prebiótica.
MÉTODOS
Para la obtención del almidón se utilizaron papas blancas y rosas que se adquirieron en mercados públicos y tiendas comerciales del Distrito Federal. Se trabajó con almidón de maíz comercial para comparar los resultados con un almidón de diferente origen. Se utilizaron 44 cepas de bacterias ácido lácticas de origen silvestre que fueron aisladas y analizadas sus propiedades probióticas en un estudio previo. También se utilizaron dos cepas de bacterias ácido lácticas comerciales Lactobacillus casei Shirota y Acti regularis como cepas probióticas control. Los parámetros medidos en el presente trabajo se analizaron por triplicado.
Purificación del almidón
Para la purificación del almidón se utilizó el método descrito por Wiesenborn et al. [11] Las papas se licuaron y el material obtenido se tamizó por las mallas no. 20 y no. 60. Este material se lavó varias veces para su purificación. El producto obtenido se dejó secar en estufa por 24 horas a 50°C.
Caracterización del almidón
Para medir la distribución del tamaño de gránulo en las muestras de almidón se utilizó el equipo de difracción de rayos láser Malvern Mastersizer WR14 1XZ.
Se calcinaron las muestras de almidón y de las cenizas obtenidas se analizó el contenido de fosfato por la técnica descrita por Ames, [12] donde se obtiene un cromóforo que se lee a 820 nm.
Para la cuantificación de la amilosa y la amilopectina en las muestras de almidón se empleó el kit enzimático Megazyme. [13] Se utilizó la separación de estos polímeros mediante la precipitación de la amilopectina con la concanavalina A dejando en el sobrenadante la amilosa que se hidrolizó a glucosa.
Ensayos de susceptibilidad a la degradación
Para medir la cinética de la hidrólisis del almidón se utilizó el método reportado por Heitmann et al., [14] con algunas modificaciones. El almidón se expuso a la degradación por la acción de la enzima amiloglucosidasa (E.C 3.2.1.3) de Rhizopus sp. de Sigma. Se midieron los azúcares reductores liberados por la hidrólisis a diferentes tiempos: 0, 20 y 40 minutos, además de 1, 1.5, 2, 3 y 24 horas. Los azúcares reductores se analizaron mediante la reducción del ácido dinitrosalicílico. [15]
Para medir la susceptibilidad a la hidrólisis ácida de las muestras de almidón se utilizó el método propuesto por Vasanthan y Bhatty [16] con algunas modificaciones. Las muestras de almidón se suspendieron en ácido clorhídrico 2.2 N. De este material se tomaron alícuotas a diferentes tiempos: 0, 1, 2, 6 y 14 días. Las alícuotas fueron neutralizadas y se midieron los azúcares reductores liberados.
Se realizó el ensayo in vitro para la determinación del almidón resistente (AR) midiendo el grado de susceptibilidad a la degradación por acción enzimática ya que este tipo de almidón se define como la fracción de almidón que resiste la digestión enzimática después de 120 minutos. [8] Se utilizó el método descrito por Silvester et al., [17] con algunas modificaciones. El valor del AR se determinó utilizando la siguiente fórmula:
AR % = (glucosa total-glucosa liberada en 120 min digestión/glucosa total)*100
Se utilizaron 44 cepas de bacterias ácido lácticas de origen silvestre que se aislaron y cuyas propiedades probióticas se analizaron en un estudio previo. Las cepas congeladas en caldo MRS (Man, Rogosa y Sharpe) con 10% de glicerol se sembraron en caldo MRS durante 24 horas. De este medio se sembró por estría en cajas con agar MRS y se realizó un Gram para revisar la morfología de la bacteria.
La identificación bioquímica se realizó mediante pruebas de fermentación de carbohidratos con caldo base rojo de fenol adicionado con 1% de carbohidratos. Los carbohidratos que se utilizaron fueron: glucosa, lactosa, arabinosa, trealosa, rafinosa, xilosa y manitol. Los resultados obtenidos se compararon con los reportados por Novei. [18]
La adhesión de las bacterias a gránulos de almidón se midió por el ensayo de cosedimentación propuesto por Crittenden et al., [3] con algunas modificaciones. Las bacterias se mezclaron con una suspensión de almidón que se dejó reposar por una hora. De este material se tomó el sobrenadante en el cual se determinó la adhesión de las bacterias con el gránulo de almidón midiendo la turbidez a 540 nm y calculando con la siguiente expresión: % bacterias adheridas = 100%-(a-b/C)*100; donde a: absorbancia de la suspensión bacteriana y almidón; b: absorbancia de la suspensión de almidón y c: absorbancia de la suspensión bacteriana.
La hidrólisis del almidón por las bacterias ácido lácticas se determinó cualitativamente, empleando el método descrito por Crittenden et al. [3] Las bacterias ácido lácticas se inocularon en cajas de agar MRS con almidón 1% p/v. Se incubaron a 37°C durante 48 horas. Se adicionó solución de lugol (I2-KI) en las cajas. La presencia de almidón se identifica por una coloración azul oscura y la hidrólisis del almidón por un halo claro alrededor de la colonia.
Para la prueba de fermentación de los almidones se utilizó el medio de base caldo rojo de fenol adicionado con 0.3% de cada almidón. Este medio se inoculó con bacterias sembradas durante 24 horas en cajas de agar MRS. El medio base rojo de fenol a pH 7 es rojizo, la producción de ácidos por el proceso de fermentación reduce el pH del medio; con ello el medio cambia a un color amarillo y se determina como prueba positiva y negativa cuando no hay cambio de coloración en el medio.
Para el análisis de los productos de fermentación de las bacterias ácido lácticas se utilizó el análisis de cromatografía líquida de alta resolución mediante la técnica descrita por Ehrlich et al., [19] para la identificación de los siguientes ácidos orgánicos: acético, propiónico, butírico y láctico.
Los resultados obtenidos del contenido de fosfato y amilosa se analizaron mediante el análisis de varianza de un factor y la prueba mínima significativa de Fisher. En la hidrólisis enzimática y ácida se realizó el análisis de regresión lineal en la cual se obtuvieron las pendientes de las diferentes muestras de almidón que se compararon utilizando el análisis de varianza de un factor seguido de la prueba mínima significativa de Fisher; para estos análisis se utilizó el programa Excel de Windows 97. El ensayo de cosedimentación se analizó mediante el análisis de varianza de dos factores y se empleó el programa estadístico SPSS 11.
RESULTADOS
Se purificó el almidón de seis muestras de papas tres de papas rosas (R1, R2 y R3) y tres de papas blancas (B1, B2 y B3). Se comparó la susceptibilidad a la hidrólisis enzimática y ácida de las diferentes muestras de almidón. Además, se analizaron algunas de sus características físicoquímicas para conocer si éstas se relacionan con la susceptibilidad a la hidrólisis enzimática y ácida.
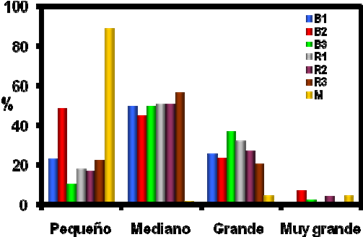
El tamaño de gránulo se determinó en las diferentes muestras de almidón (figura 1) ya que es una característica física que se relaciona directamente con la composición del gránulo y la susceptibilidad a la hidrólisis enzimática. [20]
La distribución del tamaño de gránulo de las muestras de almidón se clasificó de acuerdo con su tamaño en pequeño (< 20 μm), mediano (20 a 40 μm), grande (40 a 65 μm) y muy grande (> 65 μm). [20] Las muestras de almidón de papa tuvieron una amplia distribución de los tamaños de gránulo, mostrando su mayor composición en gránulos medianos con un promedio del 41% aunque también tienen proporciones apreciables de gránulos grandes y muy grandes, variando su contenido entre cada muestra. Estos resultados coinciden con lo que reporta Kaur et al., [20] donde los gránulos de papa siguen una distribución normal del tamaño del gránulo, que va de gránulos que miden desde 5 hasta 140 µm con una mínima proporción en gránulos pequeños y una mayor proporción de gránulos medianos y grandes. La muestra B3 presentó los porcentajes mas altos de gránulos de mayor tamaño, 34.1% de gránulos grandes y 28.9% de gránulos muy grandes, además tuvo el valor mas bajo de gránulos pequeños que fue del 2.2%. La muestra de almidón de papa R3 fue la que contenía el más alto porcentaje de gránulos de menor tamaño con un 49.5% de gránulos medianos y el menor porcentaje de gránulos muy grandes de las muestras de almidón de papa con un 12.7%.
Determinación de fosfato
Se analizó el contenido de fosfato para conocer si existe alguna variación de este componente entre las diferentes muestras de almidón, ya que el grado de fosforilación in vivo es un factor importante en la degradación de los gránulos de almidón. En la tabla 1 se muestra el contenido de fosfato de las diferentes muestras de almidón.
Muestra - μmoles de PO4/g de almidón
B1- 19.58d ± 0.54
B2- 16.54ab ± 0.64
B3- 15.46ab ± 1.29
R1- 13.54f ± 0.78
R2- 15.36a ± 0.35
R3- 17.36b ± 0.43
M- 5.52g ± 4.14
La media de los valores con diferente superíndice en la misma columna son diferentes significativamente (p< 0.05) y con el mismo superíndice no presentan diferencia. Los valores que se presentan son el promedio ± DE (n=3).
Noda et al., [21] reportaron que los gránulos de almidón de papa pequeños son los que presentan un mayor contenido de fosfato respecto a los de mayor tamaño. La muestra B1 presentó el mayor contenido de fosfato aunque no fue la muestra de almidón de papa que contenía la mayor proporción de gránulos de menor tamaño. Después de la muestra B1 la que tuvo el mayor contenido de fosfato fue la muestra R3 que de los almidones de papa representó la que tenía el mayor contenido de gránulos de menor tamaño, lo que nos indica que existen otros factores además del tamaño que influyen en el grado de fosforilación.
El almidón está compuesto principalmente por dos tipos de polímeros de glucosa, la amilosa y la amilopectina. [22] Estos dos polímeros influyen de manera determinante en la susceptibilidad a la hidrólisis ácida y enzimática. Se ha determinado que aún cuando los almidones procedan de la misma fuente botánica los que presentan mayor contenido de amilosa muestran mayor resistencia a la hidrólisis enzimática y ácida. [16] En este estudio se cuantificó el contenido de amilosa y amilopectina de las diferentes muestras de almidón. Los resultados obtenidos se presentan en la tabla 2.
Muestra |
Amilosa (%) |
Amilopectina (%) |
B1 |
18.0b ± 1 |
8.02b ± 1 |
B2 |
16.8ab ± 1.1 |
83.2ab ± 1 |
B3 |
ND |
ND |
R1 |
15.0a ± 0.3 |
85.0a ± 0.3 |
R2 |
ND |
ND |
R3 |
17.5b ± 1.7 |
82.5b ± 1.7 |
M |
10.2d ± 0.4 |
89.8d ± 0.4 |
La media de los valores con diferente superíndice en la misma columna son diferentes significativamente (p<0.05) y con el mismo superíndice no presentan diferencia. Los valores que se presentan son el promedio ± DE (n=3). ND=no determinado.
La amilosa en el gránulo de almidón constituye del 17 al 27% en los órganos de almacenamiento como en el endospermo de los granos de maíz y el tubérculo en la papa. [23]. Generalmente el contenido de amilosa en el maíz es de 27% [23,25] y en la papa es de 22%. [23] En el presente trabajo el maíz presentó un menor contenido de amilosa que el almidón de papa, esto se debe a que el contenido de amilosa puede variar ya que en la misma especie botánica pueden existir diferencias genotípicas. [24]
En las muestras de almidón se evaluó la susceptibilidad a la hidrólisis enzimática y ácida, ya que la resistencia potencial que presenten las muestras de almidón a ellas puede determinar su capacidad para llegar al colon y ejercer su actividad prebiótica. La glucoamilasa es una exo enzima que comienza la hidrólisis en los extremos no reductores de los polisacáridos atacando enlaces α 1-4 y α 1-6, convirtiendo el almidón completamente en unidades de glucosa. [20] En la figuras 2 y 3 se muestra el curso de la hidrólisis enzimática de las diferentes muestras de almidón.
Se realizó un análisis de regresión lineal para calcular la pendiente de la hidrólisis de cada muestra (datos no mostrados). Se compararon las diferentes pendientes mediante el análisis de varianza de un factor y se obtuvo un valor de p < 0.05 por lo que existe diferencia significativa entre las diferentes pendientes. Para conocer entre qué muestras existe tal diferencia se realizó el estadístico de comparación de medias y se utilizó la prueba mínima significativa de Fisher.
El almidón de maíz se hidrolizó a mayor velocidad, mostrando diferencia significativa con respecto del almidón de las diferentes muestras de papa. Las muestras de almidón de papa mostraron un comportamiento similar en la hidrólisis enzimática a excepción de la muestra de almidón B2, que presentó el valor más bajo de la pendiente, lo que indica una menor liberación de glucosa durante el tiempo de digestión, es decir, fue la muestra con mayor resistencia a la degradación enzimática.


Ensayo de susceptibilidad a la hidrólisis ácida
El ácido clorhídrico hidroliza, al azar, los enlaces glicosídicos de las cadenas del almidón; al transcurrir la hidrólisis, el almidón se va solubilizando en la solución acuosa del ácido. [16] Todas las muestras de almidón mostraron una mayor velocidad de hidrólisis del día 1 al 6, después de este periodo se presentó una menor liberación de azúcares reductores (Figura 4). Se realizó un análisis de regresión lineal para calcular la pendiente de la hidrólisis de cada muestra de almidón (datos no mostrados). Se compararon las diferentes pendientes mediante el análisis de varianza de un factor y se obtuvo un valor de p < 0.05, por lo que existe diferencia significativa entre las diferentes pendientes. Para conocer entre que muestras existe tal diferencia se realizó el estadístico de comparación de medias y se utilizó la prueba mínima significativa de Fisher.
En este ensayo los almidones presentaron un comportamiento similar ante el ataque del ácido clorhídrico 2.2 N, ya que no se presentó que algún almidón tuviera una mayor degradación con respecto a todas las muestras. No obstante las muestras B1 y R3 presentaron los valores más bajos de la pendiente que se relaciona con la menor liberación de glucosa durante el tiempo de degradación enzimática.

Contenido de almidón resistente
Con el objeto de evaluar la fracción de almidón que puede llegar al colon para ejercer su capacidad prebiótica se cuantificó el almidón resistente (tabla 3). Se encontró que el almidón de papa presentó un alto contenido de AR de aproximadamente 80%.
Muestra |
Almidón resistente (%) |
B1 |
70.8b ± 2.7 |
B2 |
80a ± 2.2 |
B3 |
79.5a ± 2.1 |
R1 |
81.5a ± 2.7 |
R2 |
80.9a ± 1.2 |
R3 |
73.2b ± 1.4 |
M |
44.7d ± 0.9 |
La media de los valores con diferente superíndice en la misma columna son diferentes significativamente (p<0.05), con el mismo superíndice no presentan diferencia. Los valores que se presentan son el promedio ± DE (n=3).
Selección de las muestras de almidón para el estudio de la capacidad prebiótica Después de haber caracterizado el almidón de las diferentes muestras, para los ensayos de la capacidad amilolítica de las bacterias, el de cosedimentación y el de fermentación del almidón se seleccionaron de las seis muestras de almidón, mismas que presentaron alguna característica que las distinguiera para, con ello, tener un lote de almidones de papa con características diferentes entre sí y, de esta manera, estudiar si alguna de estas muestras tiene alguna ventaja prebiótica. Se seleccionaron las muestras: B3, R3, B2 y R2. Las muestras B3 y R3 fueron seleccionadas ya que la muestra de papa B3 presentó los gránulos de mayor tamaño, en tanto la muestra R3 contenía la mayor proporción de gránulos de menor tamaño. La muestra B2 se seleccionó porque mostró la mayor resistencia al ataque enzimático y, finalmente, la muestra R2 presentó un comportamiento intermedio a su susceptibilidad a ser hidrolizada. Para comparar los resultados con un almidón de diferente origen se utilizó el almidón de maíz.
El patrón bioquímico de las BAL estudiadas correspondió al género Lactobacillus con 18 cepas y el género Streptococcus con 26 (resultados no mostrados).
Se realizó el ensayo de cosedimentación para evaluar la capacidad de las bacterias para adherirse a los gránulos de almidón, los resultados se muestran en la tabla 4.
Almidón |
B3 |
B2 |
R3 |
R2 |
M |
Cepa |
Bacterias adheridas al gránulo de almidón (%) |
||||
ACC2 |
82.5 |
85.5 |
77.9 |
84.3 |
80.1 |
ACC3 |
89.1 |
82.8 |
82.1 |
85.2 |
84.3 |
ACC4 |
NC |
NC |
75.1 |
91.5 |
91.8 |
APB1 |
89.2 |
84 |
NC |
NC |
NC |
APB2 |
99.8 |
97.1 |
98.8 |
NC |
NC |
APB3 |
NC |
88.6 |
98.1 |
NC |
94.6 |
APC1 |
94.4 |
93 |
91.9 |
86.6 |
88.9 |
EB2 |
98.5 |
92.8 |
NC |
905 |
94.1 |
LB1 |
96.4 |
96.4 |
NC |
NC |
NC |
VB1 |
88.9 |
83.2 |
94.7 |
95.9 |
NC |
VB2 |
97.1 |
90.6 |
NC |
NC |
NC |
VB7 |
NC |
NC |
NC |
NC |
NC |
VB11 |
97.8 |
59.9 |
NC |
NC |
NC |
VB12 |
NC |
NC |
NC |
NC |
NC |
VB14 |
NC |
96.1 |
90 |
94.9 |
99.4 |
VB17 |
94.0 |
98.6 |
93.7 |
97.7 |
92.5 |
VB19 |
94.1 |
NC |
98 |
88.1 |
91.5 |
VB20 |
NC |
89.8 |
95.3 |
85 |
95.3 |
VC1 |
99.1 |
NC |
96.1 |
NC |
NC |
VC5 |
92.5 |
94.3 |
93.5 |
86.2 |
83.3 |
VC6 |
99.1 |
97.4 |
48.2 |
96.3 |
NC |
VC7 |
96.7 |
NC |
93.8 |
85.6 |
NC |
VC8/O |
86.4 |
94.8 |
88.5 |
89.5 |
96.8 |
L. casei |
93.0 |
95.1 |
93.1 |
93.3 |
97.5 |
Acti regularis |
91.3 |
94.4 |
88.8 |
89.5 |
92.1 |
ACC1/O |
97.2 |
NC |
91.9 |
89.2 |
83 |
ACC1/T |
92.7 |
89.4 |
88.8 |
85.2 |
98.7 |
APB5 |
79.7 |
84.9 |
90.7 |
96.4 |
NC |
APB4 |
NC |
87.6 |
94.3 |
NC |
94.2 |
EB1/O |
NC |
99 |
96.2 |
85 |
90.2 |
EB1/T |
89.9 |
98.8 |
96.8 |
96.2 |
91.1 |
VB3 |
93.3 |
96.2 |
89.5 |
92.8 |
93,5 |
VB4 |
87 |
81 |
84.3 |
86.3 |
87.6 |
VB5 |
91.6 |
95.1 |
89.8 |
85 |
85.7 |
VB6 |
90.7 |
93.9 |
89.1 |
89.4 |
96.7 |
VB8 |
92.8 |
99.2 |
87.9 |
78.1 |
NC |
VB9 |
89.2 |
89.2 |
82.6 |
85.9 |
97.6 |
VB10 |
83.5 |
99.4 |
86 |
91.4 |
NC |
VB15 |
94.3 |
87.2 |
89.5 |
83.4 |
NC |
VB16 |
95.9 |
99.4 |
90.7 |
88.5 |
NC |
VB21 |
915 |
NC |
NC |
90.2 |
98 |
VC2 |
96 |
99.3 |
96.0 |
86.1 |
94.3 |
VC3 |
NC |
NC |
NC |
NC |
NC |
VC4 |
96.4 |
94.7 |
88.5 |
92.7 |
NC |
VC8 /T |
89.1 |
88.1 |
91.1 |
86.8 |
98.6 |
VC9 |
94.9 |
93.7 |
98.5 |
NC |
NC |
NC=no cuantificable
Por el análisis de varianza de dos factores se obtuvo que un valor de p > 0.05, por lo que se determinó que no hay diferencia significativa de la capacidad de adhesión de las bacterias ácido lácticas a alguna de las muestras de almidón, ni tampoco existe alguna bacteria que posea mayor adherencia a las muestras de almidón con respecto a todas las demás. Esta colección de bacterias ácido lácticas silvestres presentó una alta adhesión al almidón de papa y maíz.
La hidrólisis del almidón fue negativa para las 44 cepas evaluadas.
No obstante que el almidón no fue hidrolizado por las BAL estudiadas, se realizó el estudio tendiente a la identificación de los ácidos orgánicos producidos por la fermentación de la glucosa, que es uno de los productos de la hidrólisis del almidón por la digestión ácida y enzimática que se presenta a través del tracto gastrointestinal. Se ha reportado que cierta fracción de esta glucosa no se absorbe en el intestino delgado, lo que genera un sustrato de fermentación para estas bacterias. Por otro lado, también la hidrólisis del almidón resistente por las bacterias amilolíticas del colon produce glucosa. [17] Debido a que el almidón de maíz y papa no fueron sustrato de fermentación de las BAL utilizadas en este estudio, se utilizó la glucosa como sustrato para conocer los AGCC que estas bacterias producen al fermentar la glucosa.
Se encontró ácido acético presente en las muestras, ya que dentro del medio de cultivo se encuentra el acetato de sodio, que constituye una fuente de carbono para las bacterias. Por lo que respecta a los demás componentes del medio, éstos no interfieren con los tiempos de retención del resto de los ácidos. Para conocer si la bacteria aportaba ácido acético se traslaparon los cromatogramas del medio de cultivo con el medio fermentado por la bacteria (figura 5).

Los picos del ácido acético que muestra el medio de cultivo sin inocular y el medio fermentado por la bacteria VB11, presentaron la misma área, por lo tanto el ácido acético presente está dado por el medio de cultivo, no por la fermentación de la bacteria.
En los cromatogramas se observó que el ácido que se encuentra en mayor proporción fue el láctico, mientras el ácido propiónico y el butírico en las cepas que los presentaron estuvieron en mínima proporción. En la tabla 5 se muestran los ácidos orgánicos producidos por la fermentación de las bacterias estudiadas.
Ácidos orgánicos |
||||
Cepa |
Láctico |
Acético |
Propiónico |
Butírico |
ACC2 |
+ |
- |
- |
- |
ACC3 |
+ |
- |
- |
- |
ACC4 |
+ |
- |
- |
+ |
APB1 |
+ |
- |
- |
- |
APB2 |
+ |
- |
- |
+ |
APB3 |
+ |
- |
- |
- |
APC1 |
+ |
- |
- |
+ |
EB2 |
+ |
- |
- |
- |
LB1 |
+ |
- |
- |
+ |
VB1 |
+ |
- |
- |
+ |
VB2 |
+ |
- |
- |
- |
VB7 |
+ |
- |
- |
+ |
VB11 |
+ |
- |
- |
+ |
VB12 |
+ |
- |
- |
+ |
VB14 |
+ |
- |
- |
- |
VB17 |
+ |
- |
+ |
- |
VB19 |
+ |
- |
- |
- |
VB20 |
+ |
- |
- |
- |
VC1 |
+ |
- |
- |
- |
VC5 |
+ |
- |
- |
- |
VC6 |
+ |
- |
- |
- |
VC7 |
+ |
- |
- |
- |
VC8/O |
+ |
- |
+ |
- |
L.casei |
+ |
- |
- |
+ |
Acti regularis |
+ |
- |
- |
+ |
ACC1/O |
+ |
- |
- |
- |
ACC1/T |
+ |
- |
- |
- |
APB5 |
+ |
- |
- |
- |
APB4 |
+ |
- |
- |
- |
EB1/O |
+ |
- |
- |
+ |
EB1/T |
+ |
- |
- |
- |
VB3 |
+ |
- |
- |
- |
VB4 |
+ |
- |
- |
+ |
VB5 |
+ |
- |
- |
- |
VB6 |
+ |
- |
- |
- |
VB8 |
+ |
- |
- |
- |
VB9 |
+ |
- |
- |
- |
VB10 |
+ |
- |
- |
- |
VB15 |
+ |
- |
- |
- |
VB16 |
+ |
- |
- |
- |
VB21 |
+ |
- |
- |
- |
VC2 |
+ |
- |
- |
- |
VC3 |
+ |
- |
- |
- |
VC4 |
+ |
- |
- |
- |
VC8/T |
+ |
- |
- |
- |
VC9 |
+ |
- |
- |
- |
+=presente en el medio de fermentación; -=ausente en el medio de fermentación
DISCUSIÓN
En la hidrólisis enzimática (figuras 2 y 3), de acuerdo con los resultados obtenidos, la muestra de almidón de maíz presentó la mayor susceptibilidad a la hidrólisis enzimática. La mayor resistencia a la hidrólisis enzimática que tuvo el almidón de papa se puede explicar por las diferencias en sus características físicoquímicas. En primer lugar, el tamaño del gránulo es un factor que interviene en la susceptibilidad a la hidrólisis enzimática como lo demostraron Vasanthan y Bhatty [16] cuando estudiaron la hidrólisis de diferentes muestras de almidón de cebada, éstos se expusieron al ataque enzimático con α-amilasa y el almidón de cebada que contenía la mayor proporción de gránulos pequeños presentó la mayor velocidad de hidrólisis. Los gránulos de almidón de papa presentaron una alta proporción de gránulos medianos y grandes, en tanto el almidón de maíz tuvo una distribución predominante de gránulos pequeños, por lo que este último tiene una mayor área superficial para el ataque enzimático. [26]
Kuakpetoon y Wang [27], reportaron que a mayor contenido de amilosa la región amorfa del almidón disminuye. En diferentes estudios se ha demostrado que la región amorfa del almidón es la más susceptible tanto a la degradación enzimática como a la ácida, mientras que la región cristalina muestra mayor resistencia. [16] En el presente trabajo el almidón de maíz tuvo el menor contenido de amilosa, por tanto se puede suponer que tenga una mayor región amorfa que el almidón de papa. Siendo éste otro factor que influye en la susceptibilidad del almidón de maíz ante la digestión enzimática.
Por otro lado, el almidón de las muestras de papa tiene un mayor contenido de fosfato que el almidón de maíz y este mineral se ha relacionado como un factor que influye en la degradación del almidón. [28] Sin embargo, este factor no afectó la resistencia al ataque enzimático que mostraron los almidones de papa sobre el almidón de maíz.
Las muestras de almidón de papa mostraron un comportamiento similar en la hidrólisis enzimática, a excepción de la muestra almidón B2 que presentó la mayor resistencia al ataque enzimático de manera significativa. Por lo que respecta a su tamaño de gránulo, la muestra B2 presentó un 23.5% de gránulos muy grandes, siendo la segunda muestra con el mayor contenido de esta fracción de gránulos. De acuerdo con los resultados obtenidos (figuras 2 y 3) después de la muestra B2, el almidón que presentó una menor susceptibilidad a la degradación enzimática fue la muestra B3, que fue el almidón que presentó la mayor proporción de los gránulos grandes y muy grandes. Por lo tanto, el tamaño de gránulo fue un factor que determinó la resistencia que presentaron los almidones frente al ataque enzimático. En cuanto al contenido de fosfato y de amilosa, la muestra B2 no presentó alguna diferencia significativa con respecto a las demás muestras de almidón de papa, por lo que probablemente, además del tamaño del gránulo, la resistencia a la degradación enzimática que presentó podría estar dada por algún otro factor no determinado en este trabajo, como el contenido de lípidos, puesto que se ha demostrado que el complejo amilosa-lípidos reduce la hidrólisis enzimática porque interfiere con el enlace de la enzima con el almidón. [29]
El almidón de maíz no presentó una mayor susceptibilidad a la hidrólisis ácida respecto al de papa, como sucedió en la hidrólisis enzimática, lo que podría atribuirse a la estructura cristalina tipo A que presenta el maíz al presentar cadenas de amilopectina cortas que se encuentran más estrechamente empaquetadas. Esta organización compacta no facilita la penetración del ácido confiriendo al almidón de maíz mayor resistencia ante este tipo de hidrólisis. [16]
Las muestras B1 y R3 fueron las que presentaron una mayor resistencia a la degradación del ácido, este hecho se podría explicar porque fueron las muestras de almidón que tuvieron el mayor contenido de amilosa. Tanto en la hidrólisis ácida como en la enzimática, la parte más susceptible a la degradación es la región amorfa del almidón. La diferencia entre los dos tipos de digestión es la especificidad del ataque. La hidrólisis enzimática tiene mayor especificidad que la ácida, ya que actúa en un tipo de enlace que puede ser α 1-4 y/o α 1-6, según la enzima que esté actuando, mientras que la hidrólisis ácida no tiene especificidad. [29] La diferencia entre la cinética de reacción de la hidrólisis enzimática y ácida se puede observar en las figuras (2, 3 y 4), donde es posible apreciar que la hidrólisis enzimática de las muestras de almidón tiene una mayor velocidad de reacción que cuando se expusieron al ácido clorhídrico. Estos resultados coinciden con los reportados por Vasanthan y Batthy. [16]
Debido a la resistencia que presentó el almidón de papa a la degradación enzimática se obtuvo un contenido de AR del 80% en promedio; mientras que el almidón de maíz, por su mayor susceptibilidad, tan sólo tuvo un 44.6% de este tipo de almidón. Por lo tanto el almidón de papa, por su alto contenido de AR, puede ser un potencial prebiótico puesto que puede llegar al colon para ser sustrato de las bacterias amilolíticas presentes en él. [30]
Las BAL utilizadas en este estudio no presentaron la capacidad para hidrolizar el almidón de maíz y de papa en moléculas más sencillas como glucosa, maltosa o dextrinas; con esto no es posible la utilización como sustrato de fermentación, ya que este polisacárido es demasiado complejo para entrar en una célula bacteriana y ser catabolizado. [31]
Wang et al., [30] reportaron que las bifidobacterias aisladas de la microbiota del colon presentan la capacidad de adhesión a gránulos de amilomaíz. Estudios posteriores de cosedimentación, con varias cepas de bifidobacterias y diferentes almidones de maíz, papa y cebada muestran que las bifidobacterias tienen 90% de adhesión a los gránulos de maíz, mientras que a los gránulos de papa presentaron un 70%. De igual manera, en nuestro trabajo la capacidad de adhesión de las bacterias entre el almidón de maíz y el de papa presentaron un alto porcentaje de bacterias adheridas al gránulo (75% al 99%). Debido al alto porcentaje de AR en la papa, éste podría conferir protección a las bacterias hacia los principales factores que disminuyen su viabilidad al pasar por el tracto gastrointestinal, ya que se ha reportado que cuando se exponen las bacterias adheridas con el almidón de amilomaíz a dichos factores, las bacterias mostraron mayor resistencia que cuando se presentaron las bacterias solas a estas condiciones. En estudios in vivo se recobran mayores cuentas de bifidobacterias en las heces de ratones a los cuales se les administró bifidobacterias junto con el almidón, que cuando se administraron las bacterias solas. [30]
Por otro lado la capacidad de adhesión y fermentación a gránulos de almidón de papa por BAL se había estudiado por Crittenden et al., [3] donde utilizaron bifidobacterias aisladas del intestino humano. Éstas demostraron capacidad amilolítica, además de presentar adhesión a los gránulos de almidón de papa. En dicho estudio se determinó que la actividad amilolítica no es un requisito para la capacidad de adhesión al gránulo de almidón que presentaron las bacterias, ya que aunque todas las bifidobacterias que utilizaron en la prueba de cosedimentación presentaron actividad amilolítica, no todas mostraron un alto porcentaje de adhesión. En el presente trabajo se confirmó este hecho ya que tanto el almidón de maíz como el de papa no son hidrolizados por las bacterias ácido lácticas silvestres y las bacterias probióticas control, sin embargo, esta colección de bacterias muestran una alta adhesión al almidón de papa. Esta asociación de la bacteria con el almidón, como se indicó anteriormente, sirve de protección a las condiciones del tracto gastrointestinal, de tal forma que pueden llegar un mayor número de bacterias viables al colon, donde el almidón de papa pueda ser hidrolizado por otras bacterias del colon que posean actividad amilolítica y, a su vez, los productos de la degradación del almidón podrán ser utilizados por las bacterias del colon dentro de las que se encuentran las bacterias ácido lácticas. El conjunto de estas bacterias produce, como productos finales de fermentación, ácido láctico y los AGCC que acidifican el medio, con lo que se estimulan tanto la absorción de minerales como la laxación. [32]
De acuerdo con la identificación de los ácidos orgánicos producidos como metabolitos de fermentación por las BAL analizadas se encontró que el ácido láctico fue el principal producto de fermentación, como era de esperarse; sin embargo, 12 /44 cepas estudiadas produjeron pequeñas cantidades de ácido butírico, componente que estimula la reproducción de las células de la mucosa intestinal, por lo que estas bacterias proveen de un beneficio adicional a la salud, además de los beneficios que potencialmente presentan las BAL para el hombre.
CONCLUSIONES
Los resultados indican que el tamaño y el contenido de amilosa son características importantes de los gránulos de almidón en la definición de la susceptibilidad a la hidrólisis enzimática y ácida respectivamente. El almidón de papa presentó un 80% de almidón resistente y, no obstante que las bacterias ácido lácticas estudiadas no presentaron actividad amilolítica, otras bacterias presentes en el colon podrían utilizar este almidón para producir ácidos grasos de cadena corta. Además, las bacterias estudiadas presentaron una alta capacidad de adhesión a los gránulos de almidón de papa, por lo que éste puede ser un prebiótico potencial para las bacterias amilolíticas del colon.
1 Trabajo ganador de la Medalla “Hno. Salvador González 2008”, Nivel: Licenciatura, Categoría: Avanzada, Área: Ciencias de la Salud, XV Jornadas de Investigación, Universidad La Salle, mayo de 2008.
REFERENCIAS
[1] Fergus, C. (2004). Functional Foods: Opportunities and Challenges, IFT Expert Panel Report, Chicago: John Wiley & Sons, Inc., vol. 58, no. 12, pp. 35-40.
[2] Figueroa, V. J. L., Chi, M. E. E., Cervantes, R. M. y Domínguez, V. I. A. (2006). Alimentos funcionales para cerdos al destete, Veterinaria, México: Facultad de Medicina Veterinaria y Zootecnia, vol. 37, no. 1, pp. 117-136. [En línea] Disponible en:
<http://www.fmvz.unam.mx/fmvz/revvetmex/a2006/rvmv37n1/rvm37109.pdf>, consulta: julio 27 d e2007.
[3] Crittenden, R., Laitila, A., Forssell, P., et al. (2001). Adhesion of Bifidobacteria to Granular Starch and its Implication in Probiotic Technologies, Applied Environmental Microbiology, USA: The American Society for Microbiology, vol. 67, no. 8, pp. 3469- 3475.
[4] Holzapfel, W. H., Haberer, P., Geisen, R., et al. (2001). Taxonomy and Important Features of Probiotic Microorganisms in Food Nutrition, American Journal of Clinical Nutrition, USA: The American Society for Nutrition, vol. 73, pp. 365-373.
[5] Liong, M. T. y Shah, N. P. (2005). Optimization of Cholesterol Removal by Probiotics in the Presence of Prebiotics by Using a Response Surface Method, Applied and Environmental Microbiology, USA: The American Society for Microbiology, vol. 71, no. 4, pp. 1745-1753.
[6] Roberfroid, M. (2001). Prebiotics: Preferential Substrates for Specific Germs?, American Journal of Clinical Nutrition, USA: The American Society for Microbiology, vol. 73, pp. 406- 409.
[7] Gibson, G. R. y Roberfroid, M. B. (1994). Dietary Modulation of the Human Colonic Microbiota: Introducing the Concept of Prebiotcs, The Journal of Nutrition, USA: The American Society for Nutrition, vol. 125, pp. 1401-1412.
[8] Sajilata, M. G., Sighal, R. S. y Kulkarni, P. R. (2006). Resistant Starch a Review, Comprehensive Reviews in Food Science and Food Safety, Chicago: John Wiley & Sons, Inc., vol. 5, no. 1, pp. 1-17, jamuary.
[9] Bird, A. R., Brown, I. L. y Topping, D. L. (2000). Starches, Resistant Starches, the Gut Microflora and Human Health, Current Issues Intestinal Microbiology, UK: Horizon Scientific Press, vol. 1, no.1, pp. 25-37. [En línea] Disponible en:
<http://www.horizonpress.com/ciim/v/v1/03.pdf >, consulta: agosto 13 de 2007.
[10] Miller, T. L. y Wolin, M. J. (1996). Pathways of Acetate, Propionate, and Butirate Formation by the Human Fecal Microbial Flora, Applied and Enviromental Microbiology, EUA: The American Society for Microbiology, vol. 62, no. 5, pp. 1589- 1592.
[11] Wiesenborn, D. P., Orr, P. H., Casper, H. H. y Tacke, B. K. (1994). Potato Starch Paste Behavior as Related to Some Physical Chemical Properties, Journal of Food Science, Chicago: Mission, vol. 59, no. 3, pp. 644-648.
[12] Ames, B. N. (1996). Assay of Inorganic Phosphate, Total Phosphate and Phosphatase, Methods in Enzymology, UK: Elsevier, vol. 8, pp. 115-117.
[13] Megazyme International Ireland Limited. (2006). Amylose/Amilopectin procedure, [En línea], Disponible en: <http://secure.megazyme.com/downloads/en/dat/k-AMYL.pdf>, consulta: julio 27 de 2007.
[14] Heitmann, T., Wenzing, E. y Mersmann, A. (1997). Characterization of Three Different Potato Starches and Kinetics of their Enzymatic Hydrolysis by an α-amylase, Enzyme and Microbial Technology, GB: Elsevier, vol. 20, no. 4, pp. 259-267.
[15] Miller, G. L. (1959). Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar, Analitical Chemestry, USA: ACS, vol. 31, no. 3, pp. 426-428.
[16] Vasanthan, T. y Bhatty, R. S. (1996). Physicochemical Properties of Small and Large Granule Starches of Waxy, Regular, and High Amilose Barleys, Cereal Chemistry, USA: AACC International, vol. 73, no. 2, pp. 199- 207.
[17] Silvester, K. R., Englyst H. N. y Cummings J. H. (1995). Ileal Recovery of Starch from Whole Diets Containing Resistant Starch Measured in vitro and Fermentation of Ileal Effluent, American Journal of Clinical Nutrition, USA: The American Society for Nutrition, vol. 62, pp. 403-411.
[18] Novei, G. (2000). Bacterias ácido lácticas, En: Leveau, J. Y., Bouixi, M. (ed). Microbiología industrial. Los microorganismos de interés industrial, España: Acribia, pp. 238-239.
[19] Ehrlich, G. G., Goerlitz, D. F., Bourell, J. H., et al. (1981). Liquid Chromatographic Procedure for Fermentation Product Analysis in the Identification of Anaerobic Bacteria, Applied Environmental Microbiology, USA: The American Society for Microbiology, vol. 42, no. 5, pp. 878-885.
[20] Kaur, L., Singh, J., McCarthy, O. J., et al. (2007). Physico-Chemical, Rheological and Structural Properties of Fractionated Potato Starches, Journal of Food Engineering, UK: Elsevier, vol. 82, no. 3, pp. 383-394.
[21] Noda, T., Takigawa, S., Matsuura-Endo, C., et al. (2005). Physicochemical Properties and Amylopectin Structures of Large, Small, and Extremely Small Potato Starch Granules, Carbohydrate Polymers, UK: Elsevier, vol. 60, pp. 245-251.
[22] Denyer, K., Johnson, P., Zeeman, S. y Smith, A. M. (2001). The Control of Amylose Synthesis, Journal of Plant Physiology, UK: Elsevier, vol. 158, pp. 479-487.
[23] Badui, D. S. (1993). Química de los alimentos. 3 ed., México: Pearson Educación, pp.
94-97.
[24] Gérard, C., Colona, P., Buléon, A. y Planchot, V. (2001). Amylosis of Maize Mutant Starches, Journal of the Science of Food and Agricultura, UK: Society of Chemical Industry, vol. 81, pp. 1281-1287.
[25] Oates, C. G. (1997). Towards an understanding of starch granule structure and hydrolysis. Trends in Food Science & Technology. November, UK: Elsevier, vol. 8, no. 11, pp. 375-382.
[26] Ring, S. G., Gee, J. M., Whittam, M., Orford, P. y Johnson, I. T. (1988). Resistant Starch: its chemical form in foodstuffs and effect on digestibility in vitro. Food Chemistry. UK: Elsevier, vol. 28, no. 2, pp. 97-109.
[27] Kuakpetoon, D. y Wang, Y. (2007). Internal Structure and Physicochemical Properties of Corn Starches as Revealed by Chemical Surface Gelatinization, Carbohydrate Research, UK: Elsevier, vol. 342, no. 15, pp. 2253-2263.
[28] Blennow, A., Engelsen, S. B., Nielsen, T. H., Baunsgaard, L. y Mikkelsen, R. (2002). Starch Phosphorylation: a New Front Line in Starch Research, Trends in Plant Science, UK: Elsevier, vol. 7, no.10, pp. 445-450.
[29] Gallant, D. J., Bouchet, B. y Baldwin, P. M. (1997). Microscopy of Starch: Evidence of a New Level of Granule Organization, Carbohydrate Polymers, UK: Elsevier, vol. 32, pp. 177-191.
[30] Wang, X., Brown, I. L., Evans, A. J. y Conway, P. L. (1999). The Protective Effects of High Amylase Maize (Amylomaize) Starch Granules on the Survival of Bifidobacterium spp. in the mouse Intestinal Tract. Journal of Applied Microbiology, GB: Wiley-Blackwell, vol. 87, pp. 631-639.
[31] Mac Faddin, J. F. (1993). Pruebas bioquímicas para la identificación de bacterias de importancia clínica, México: Panamericana, pp. 27-37.
[32] Ouwehand, A. C., Derrien, M., Vos, W., Tiihonen, K. y Rautonen, N. (2005). Prebiotics and Other Microbial Substrates for Gut Functionality, Current Opinion in Biotechnology, UK: Elsevier, vol. 16, pp. 212-217.
BIBLIOGRAFÍA
Vasanthan, T. y Hoover, R. (2002). Effect of Defatting on Starch Structure and Physicochemical Properties. Food Chemistry, UK: Elsevier, vol. 45, pp. 337-347.