I. Introducción
La característica principal de los sistemas de tratamiento de agua residual biológicos (aerobios o anaerobios) es remover la materia orgánica que llega a sus influentes (Metcalf & Eddy, 2003), por otro lado, los efluentes de los sistemas de tratamiento biológico contienen una mezcla de compuestos orgánicos solubles tales como polisacáridos, proteínas, ácidos orgánicos, etc. producto de los residuos de los microorganismos. Debido a esto, la materia orgánica disuelta (MOD) causa una gran preocupación en términos del proceso de operación y el control de la calidad del efluente y es necesario conocer las características que presenta al entrar y al salir del sistema.
Alta concentración de MOD ya sea como productos microbianos solubles (PMS) o sustancias poliméricas extracelulares pueden causar un rendimiento deficiente en sistemas de tratamiento biológicos convencionales (Chen et al., 2003). Las características de la MOD están afectadas por parámetros operacionales tales como: tiempo de retención celular (TRC), tiempo de retención hidráulico (TRH), carga orgánica, y tasa comida/microorganismos (Tahir et al., 2017).
La luz puede ser absorbida y emitida por ciertos compuestos y a este proceso se lo denomina luminiscencia. Existen dos tipos: fluorescencia y fosforescencia. La fluorescencia es un fenómeno físico mediante el cual ciertas sustancias absorben energía en forma de radiación electromagnética emitiéndola en una longitud de onda mayor en un periodo de tiempo muy corto (Albani, 2007). La fluorescencia es el resultado de una serie de procesos que ocurren en ciertas moléculas llamadas fluoroforos. Dichas moléculas son generalmente orgánicas poliaromáticas o heterociclos.
Hasta ahora se han empleado varias herramientas espectroscópicas para desenredar la compleja estructura de la MOD en los sistemas de tratamiento biológico ya que la materia orgánica absorbe luz en un amplio rango de longitudes de onda. Como resultado, la absorbancia de luz es un indicador semi cuantitativo de la concentración de la materia orgánica en el agua (Korshin et al., 1997).
Dentro de las diferentes herramientas espectroscópicos, la fluorescencia ha sido aplicada recientemente a los sistemas de tratamiento para caracterizar cambios en la MOD. Debido a que es fácil de obtener y cuenta con la habilidad de proveer las características químicas de la mayor parte de la MOD (Korak et al., 2014; Tahir et al., 2017; Cohen et al., 2014; Bridgman et al., 2013).
El principal objetivo de esta investigación fue monitorear la transformación de la MOD dentro de un reactor piloto de 100 L RBS-LA el cual fue alimentado por agua cruda residual proveniente de la industria chocolatera. La MOD fue monitoreada utilizando espectroscopía de fluorescencia a través de cual se realizó el análisis visual de las EEMs del influente y del efluente para determinar los picos propuestos por Chen, et al (2003).
II. Metodología
A. Operación y monitoreo del reactor piloto RBS-LA
Se operó un RBS-LA con un volumen de 100 L previamente estabilizado para otra investigación con un TRC de 11 ± 4.39 días (tiempo establecido a partir de los cálculos realizados por Mier-Quiroga (2016)). El RBS-LA trató agua proveniente de la industria chocolatera con una concentración de demanda química de oxígeno soluble (DQOs) en su influente variable. El agua residual de la industria chocolatera que se utilizó en esta investigación es entregada con un pH ácido (5.1 ± 1.02). Debido a que los sistemas de tratamiento biológicos deben operar con un pH cercano a 7 fue necesario diluir el agua residual con el efluente del RBS-LA, de esta forma se evitó la adición de compuestos como NaOH para elevar el pH. El porcentaje de dilución se modificó con cada lote de agua residual (1000 L) debido al cambio de pH del agua residual cruda.
El TRH fue de 8 horas. El ciclo del RBS-LA consistió en una fase de aireación y mezcla de 6 horas, una fase de sedimentación de 1 hora, una fase de purga del efluente 0.5 horas y una fase de llenado 0.5 horas. Se realizaron tres ciclos por día. El RBS-LA fue operado mediante un controlador diseñado para modificar los TRH por Mier-Quiroga (2016). El RBS-LA había sido operado con TRH de 8 horas desde 12 meses previos a esta investigación y se ha monitoreado periódicamente (pH y DQOs).
El aireado y mezcla del RBS-LA para mantener 2 mg/L de oxígeno disuelto (OD) se llevó a cabo con un aireador marca GAST modelo Regenair R3 105-1. El aire fue suministrado al reactor mediante un difusor previamente diseñado y construido.
Las muestras para esta investigación se tomaron durante la fase de sedimentación 10 minutos previos al final de un ciclo (cada 24 horas) y en el influente del RBS-LA. Se tomaron 29 muestras del efluente del RBS-LA; al haber tomado 13 muestras del efluente se decidió muestrear el influente por lo que sólo se analizaron16 muestras de éste. Las muestras fueron tomadas durante un periodo de 4 meses en días aleatorios.
Todas las muestras fueron filtradas con filtros de fibra de vidrio (GF/C, Whatman). Las muestras filtradas fueron colectadas y almacenadas en viales ámbar, acidificadas a un pH de 2 y almacenadas a 4°C hasta ser analizadas. De todas las muestras se obtuvo la DQOs y se realizó su EEM. Se generó la EEM de corrección del blanco, realizándolo con agua ultrapura obtenida del desionizador Milliepore marca modelo Millie-Q Plus®.
B. Métodos analíticos
La DQOs fue determinada con un kit comercial colorimétrico de reflujo cerrado (rango alto 0-1500 mg/L DQO, Hach, Co.). Para estandarizar las muestras en este estudio y poder comparar las EEMs se diluyeron las muestras a 5 mg/L DQOs (se eligió 5 mg/L debido a que fue la dilución en donde las muestras tanto del influente como del efluente entraron en el rango de fluorescencia).
Todas las matrices EEM fueron obtenidas en un espectrómetro de fluorescencia (Modelo LS-55, Perkin Elmer, USA) equipado con una lámpara de Xenon de 150 watts como fuente de excitación. El espectrómetro se controlado con el software WINLAB en una computadora de escritorio. Las EEMs consisten en 45 escaneos de emisión (250-600 nm) recolectados en longitudes de onda de excitación de 200 a 420 nm en incrementos de 5 nm. La abertura de excitación/emisión se estableció en 10 nm. La velocidad de escaneo se fijó en 1200 nm/min.
Todos los archivos generados por WINLAB como EEMs fueron exportados a Excel®. Todos los libros de Excel generados fueron diseñados para restar el blanco a las EEMs y así eliminar las dispersiones de Rayleigh y Raman. Se realizó un análisis visual por medio del cual se detectó la mayor intensidad de fluorescencia (pico máximo) y su localización en las EEM.
III. Resultados y Discusión
A. Desempeño del RBS-LA
Debido a que existieron variaciones en la calidad del agua de la industria chocolatera la DQOs del influente se mantuvo en 523.94 ± 166.25 mg/L. A pesar de un influente variable el desempeño del RBS-LA se mantuvo estable ya que en su efluente la DQOs se obtuvo en 82.86 ± 52 mg/L con un porcentaje de remoción del 75%. El pH del influente debido a la dilución realizada para elevarlo se mantuvo en el influente en 7.06 ± 0.37 y en el efluente en 8.64 ± 17.
Los sólidos suspendidos (SS) dentro del RBS-LA no fueron analizados durante esta investigación porque ya se tiene información recolectada previa durante 250 días en donde los SS dentro del RBS-LA se mantuvieron variables debido al cambio en el influente, pero los SS en el efluente se mantuvieron en 55.23 ± 15.46 mg SS/L, independientemente de la concentración de SS del licor mixto.
B. Análisis visual de las matrices de excitación/emisión
Para llevar a cabo un correcto análisis visual de espectroscopía de fluorescencia se tomaron en cuenta las propiedades más importantes de la fluorescencia que son la localización de los picos de exctiación y emisión (sus respectivas longitudes de onda) y la intensidad máxima de fluorescencia. Si conocemos estos aspectos de la muestra analizada se pueden identificar cualitativamente los fluoróforos presentes en la muestra.
Las figuras 1 y 2 muestran las EEMs representativas del influente y efluente del RBS-LA respectivamente, mientras que las tablas 1 y 2 muestra los promedios de las intensidades de fluorescencia (IF) expresadas en unidades arbitrarias de fluorescencia (UA) y las longitudes de onda de excitación y emisión de los picos más representativos (picos A, B, C, D y E).
Debido a que el influente fue diluido con el efluente del RBS-LA se debe considerar que gran parte de su fluorescencia se puede atribuir a los PMS que se generaron dentro del reactor y no a fluorescencia presente en el agua residual cruda. La EEM del influente muesta poca IF (250 UA) respecto a la del efluente (650 UA) por lo que el primer análisis visual indica que el aumento de la fluorescencia y el cambio de forma de la EEM es debido a producción microbiana de reciente creación.
La localización de los picos A, B, C y D se compararon con las zonas establecidas en la literatura (Chen et al., 2003). Los picos A y B se identificaron como sustancias proteicas atribuidas a los PMS (triptófano) (Baghot et al., 2011). Los pico A y B tiene una mayor IF en el efluente que en el influente, esto se puede atribuir a que se ha establecido su presencia cuando existe una alta actividad microbiana (Tahir et al., 2017). El pico D por otro lado, al ubicarse dentro de la zona de las sustancias húmicas, se ha establecido como representativo de MOD refractaria resultado de la biodegradación de materia vegetal y/o animal.
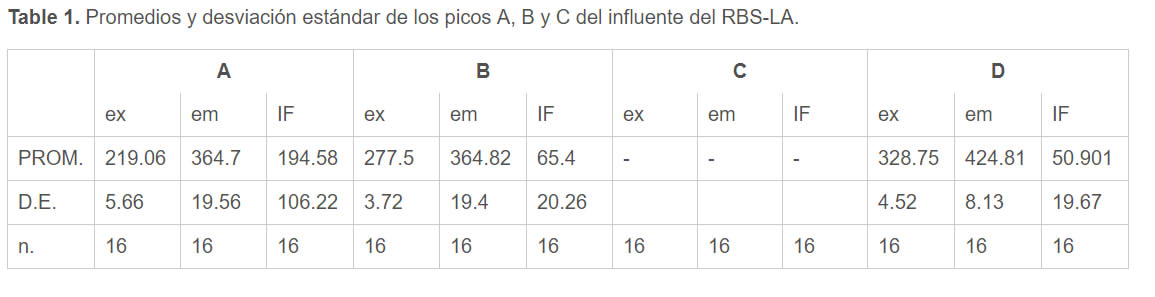 |
Promedios y desviación estándar de los picos A, B y C del influente del RBS-LA. |
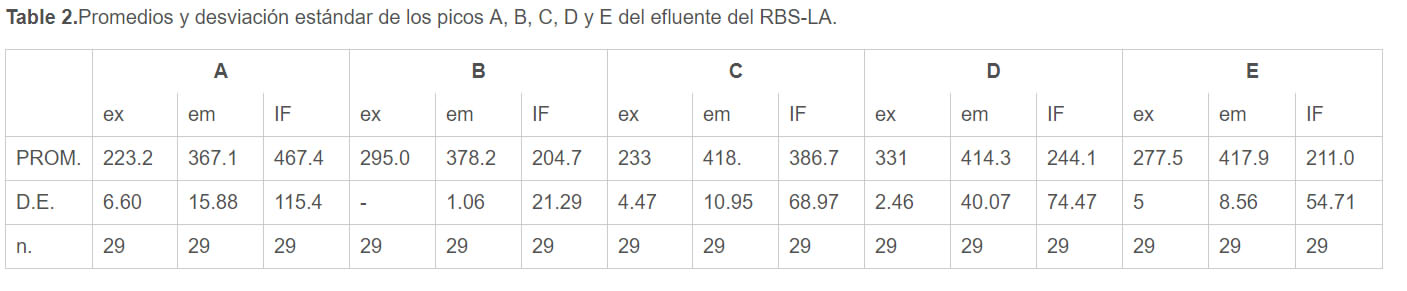 |
Promedios y desviación estándar de los picos A, B, C, D y E del efluente del RBS-LA. |
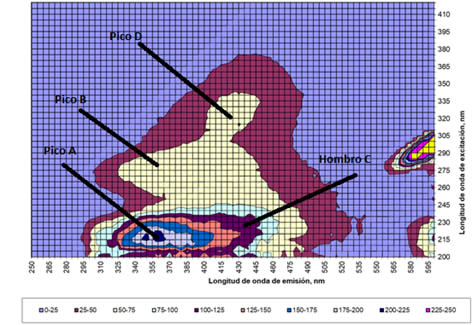 |
Matriz excitación/emisión representativa del influente del RBS-LA. Cada línea representa 25 U.A. |
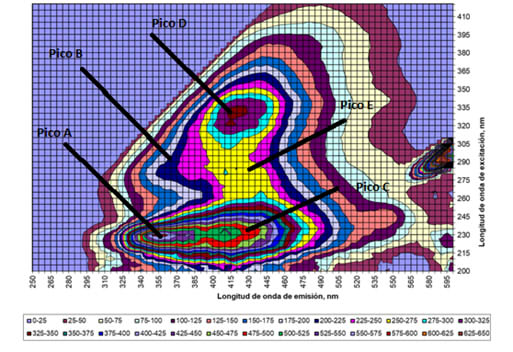 |
Matriz excitación/emisión representativa del efluente del RBS-LA. Cada línea representa 25 U.A. |
La humificación microbiana en los lodos activados y/o en el proceso de digestión se ha encontrado en diferentes estudios. Este proceso está típicamente acompañado por la producción de más estructuras aromáticas complejas, las cuales son más resistentes a la degradación microbiana (Tahir et al., 2017; McKnight et al., 2001; Stedmon et al., 2003).
El hombro C presente en el influente se ha reportado como un pico caracterizado por acompañar al pico D y establece presencia de sustancias húmicas (Komatuso et al., 2018). En el efluente se muestra el pico C ya no como hombro, esto se atribuye a que el efluente presenta mayor IF en la zona atribuida a sustancias húmicas . Se necesita un metodo analítico diferente para poder aislar al pico C y establecer sus propiedades y origenes.
El pico E solo visible en el efluente del RBS-LA y se encuentra en la zona establecida por Chen et al. (2003) como la zona de sustáncias húmicas y fúlvicas. A pesar de que las intensidades de fluorescencia del influente se ven afectadas por las del efluente debido a la mezcla producida con el agua cruda de la industria chocolatera, se tiene que resaltar que el pico E no se encuentra presente en las EEMs del influente, por lo tanto, es necesario abordar otro tipo de técnica de análisis para conocer el origen de este pico.
IV. Conclusiones
La MOD del RBS-LA fue caracterizada mediante espectroscopía de fluorescencia en su influente y efluente. Después del tratamiento las intensidades de fluorescencia de todos los picos se incrementó y apareció un pico no observado en el influente lo que indica que los cambios en las EEMs son producidos por actividad microbiana resultando en tener un aumento en los PMS.
Con el análisis visual y establecimiento de los picos máximos se encontró que existe presencia de sustancias proteicas (triptófano), sustancias húmicas con su poible hombro (pico C) que se atribuyen a la producción microbiana.
El análisis visual de la espectroscopía de fluorescencia se puede establecer con los resultados obtenidos como un análisis cualitativo, ya que la DQOs del efluente es menor que la DQOs del influente, mientras que las intensidades de fluorescencia se comportan de manera inversa. Si fuera requerido un análisis en donde se pueda comparar la MOD cuantitativamente con ayuda de la fluorescencia, es necesario hacer otro tipo de análisis como la literatura los ha establecido para aguas naturales.
Debido a lo previamente mencionado sobre la influencia de los parámetros operacionales se recomienda modificarlos y al compararlos se puedan conocer y monitorear de manera más clara la producción de las sustancias húmicas y proteicas.